ප්රධාන ශක්ති මට්ටම් (n),
න්යාෂ්ටියෙන් ඉවතට යන විට ඒවා 1, 2, 3 ආදි ලෙස ප්රධාන ක්වොන්ටම් අංකයෙන් හෝ K, L, M, N යන අක්ෂර වලින් සංකේත කරයි. ප්රධාන ශක්ති මට්ටම් හෝ ඉලෙක්ට්රෝනික කවච ලෙස මේවා හදුන්වයි.
E1 < E2 < E3 < E4

උපශක්ති මට්ටම්,
- ප්රධාන ශක්ති මට්ටම් සුළු ශක්ති වෙනස්කම් ඇතිව උපමට්ටම් වලට විභේදනය කළ හැක.
- යම් ප්රධාන මට්ටමක වූ උපමට්ටම් ගණන ප්රධාන ශක්ති මට්ටම් අංකයට සමාන වේ.
උදා : 3 වන ප්රධාන ශක්ති මට්ටමේ උපශක්ති මට්ටම් 3කි.
- මෙම උපශක්ති මට්ටම් හැදින්වීමට s, p, d, f යනාදී සංකේත භාවිතා කරයි.යම් උපශක්ති මට්ටමක් හැදින්වීමේදී එය අයත් වන ප්රධාන මට්ටම් අංකය උපශක්ති මට්ටමේ සංකේතයට කළින් ලියයි.
උදා : 4 වන ප්රධාන මට්ටමේ ඇති උපමට්ටම් ගණන හා වර්ග ලියන්න.
උපමට්ටම් ගණන = 4
උපමට්ටම් =4s 4p 4d 4f
කාක්ෂික ( සමතේජ මට්ටම් ),
S උප ශක්ති මට්ටම හැර අනෙත් සියල්ලම තවදුරටත් සූක්ෂම ලෙස උපමට්ටම් වලට බෙදා වෙන් කළ හැක.මේවා කාක්ෂික ලෙස හදුන්වයි. පරමාණුක න්යෂ්ටිය වටා ඉලෙක්ට්රෝන පැවතීමට වැඩි සම්බාවිතාවයක් සහිත ත්රිමාණ ප්රදේශය කාක්ෂිකයක් වන අතර මේවායෙ ශක්තීන් එකිනෙකට සමාන වේ. මේවා අයත් උපමට්ටම් n සංකේතයෙන් හදුන්වන අතර යම් ප්රධාන ශක්ති මට්ටමක ඇති කාක්ෂික ගණන n2 සමාන වේ.
උපශක්ති මට්ටම කාක්ෂික ඉලෙක්ට්රෝන ගණන
S 1 2
p 3 6
d 5 10
f 7 14
කාක්ෂික වල හැඩ
පරමාණුවක් වටා ඉලෙක්ට්රෝනයක් පිහිටීමේ සම්බාවිතාවය කාක්ෂික හැඩය අපට පෙන්වා දෙයි.
s කාක්ෂිකය
s උපශක්ති මට්ටමේ වූ කාක්ෂිකය මෙසේ හදුන්වයි. s කාක්ෂිකය න්යෂ්ටිය කේන්ද්ර කරගත් ගෝලීය ප්රදේශයක පවතියි. 1s කාක්ෂිකයට පිටින් 2s පිහිටයි.
න්යෂ්ටියේ සිට ඈතට යන විට ගෝලාකාර කාක්ෂිකයේ විශාලත්වය වැඩි වේ.

p කාක්ෂිකය
p උපමට්ටමේ වූ කාක්ෂිකයක් මෙසේ හදුන්වයි. මෙය ඩම්බල් ආකාර ගනියි. p උපමට්ටමේ කාක්ෂික 3ක් ඇත. ඒවා එකිනෙකට ලම්බක වන අතර වෙනස් වන්නෙ අවකාශීය දිශානතියෙනි.
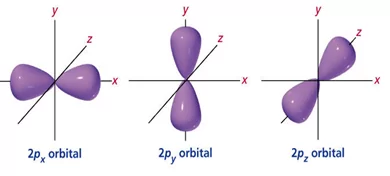
- න්යෂ්ටිය වටා p කාක්ෂික තුනෙහි පිහිටීම පහත පරිදි වේ.

- මේවාද න්යෂ්ටියේ සිට ඈතට යත්ම විශාලත්වය වැඩි වේ.
- p උපශක්ති මට්ටමේ පැවතිය හැකි උපරිම ඉලෙක්ට්රෝන ගණන 06කි.
d කාක්ෂිකය
- d උපශක්ති මට්ටමේ වූ කාක්ෂිකය d කාක්ෂිකය වේ. මේවා සංකීර්ණ හැඩයක් ගන්නා අතර කාක්ෂික 5ක් ඇත. දිශානතිය අනුව dxy, dyz, dzx, dz2, d(x2 – y2) ලෙස හදුන්වයි.
- d උපශක්ති මට්ටමේ උපරිම ඉලෙක්ට්රෝන ගණන 10කි.
f කාක්ෂිකය
- f උපශක්ති මට්ටමේ වූ කාක්ෂිකය මෙසේ හදුන්වයි.කාක්ෂික 7කි.උපරිම ඉලෙක්ට්රෝන 14කි.
| ප්රධාන ක්වොන්ටම් අංකය | ඉලෙක්. කවචය | උපශක්ති මට්ට්ටම n | උපශක්ති මට්ටම | මුළු කාක්ෂික n2 | කාක්ෂික වර්ගයට අයත් e ගණන | මුළු ඉලෙක්ට්රෝන ගණන |
| 1 | K | 1 | 1s | 1 | s 1 | 2 |
| 2 | L | 2 | 2s 2p | 4 | s p 1 3 | 8 |
| 3 | M | 3 | 3s 3p 3d | 9 | s p d 1 3 5 | 18 |
| 4 | N | 4 | 4s 4p 4d 4f | 16 | s p d f 1 3 5 7 | 32 |
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



