ආවර්තිතා වගුව ගොඩනැගීම
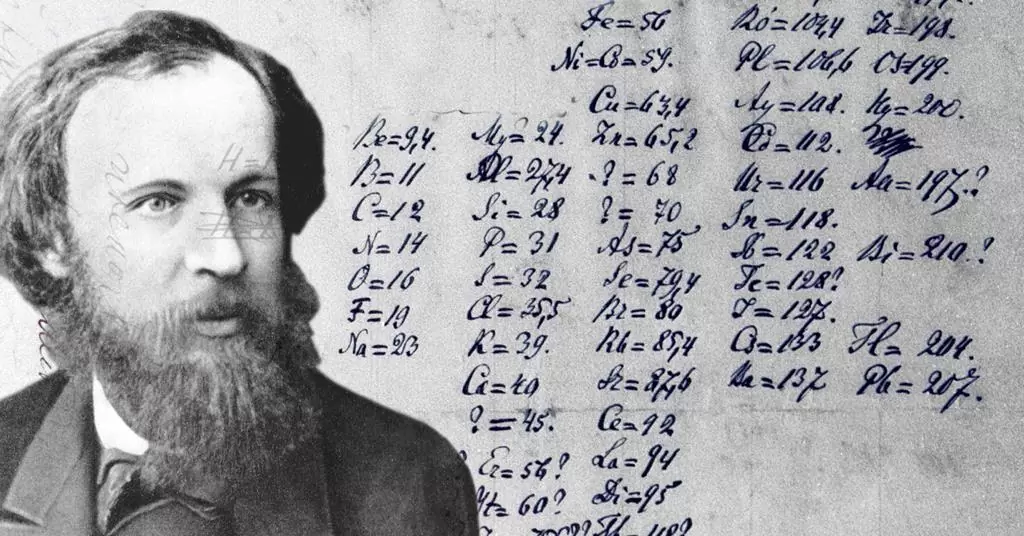
- වර්තමානය වන විට මූලද්රව්ය 112 ක් පමණ සොයා ගෙන ඇති අතර ඒවා වෙනම අධ්යයනය දුෂ්කර බැවින් මූලද්රව්ය වර්ගීකරණය කර ඇත.
- ආවර්තිතා වගුව සකස් කිරීමේදී දිමිත්රි මෙන්ඩලීෆ් සහ ලෝදර් මේයර් බොහෝ දුරට සමාන වූ වර්ගීකරණ පටිපාටි ප්රකාශ කළහ.
- මෙන්ඩලීෆ්ගේ වර්ගීකරණයේදී මූලද්රව්ය ඒවායේ පරමාණුක ස්කන්ධ වල ආරෝහණ පිළිවෙළට අනුව තැබූ විට සමාන භෞතික හා රසායනික ගුණ වලින් යුක්ත මූලද්රව්ය පුනරාවර්ති වේ ලෙස ප්රකාශ කළේය.
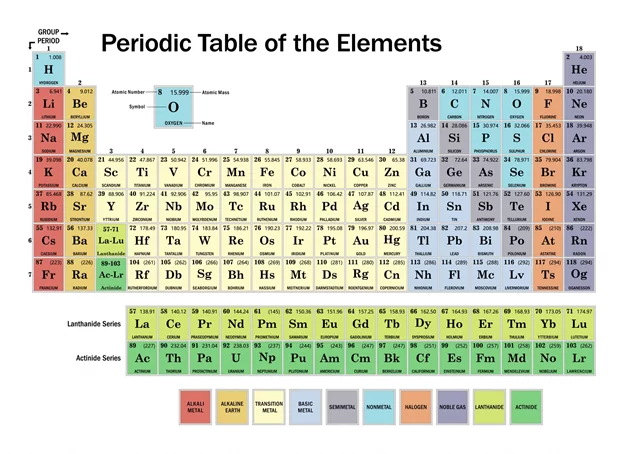
නූතන ආවර්තිතා වගුව
- මෙන්ඩලීෆ්ගේ ආවර්තිතා නියමයේ සාපේක්ෂ පරමාණුක ස්කන්ධය වෙනුවට පරමාණුක ක්රමාංකය භාවිතා කර සංශෝධනය කිරීමෙන් නූතන ආවර්තිතා වගුව ලබා ගෙන ඇත.
- මූලද්රව්ය වල භෞතික හා රසායනික ගුණ ඒවායේ පරමණුක ක්රමාංකයන්හි ආවර්තිතා විචලනයක් හෙවත් ශ්රිතයක් වන පරිදි වර්ග කිරීමෙන් ගොඩ නගා ඇත.
- ආවර්තිතා වගුවේ සිරස් මූලද්රව්ය රටා/තීරු කාණ්ඩ නම් වේ.
- තිරස් මූලද්රව්ය රටා/ වගුවේ පේළි ආවර්ත නම් වේ.
මූලද්රව්ය ආවර්ත වලට වෙන් කිරීම
- ප්රධාන ශක්ති මට්ටමකට ඉලෙක්ට්රෝන ඇතුළු වීම ඇරඹෙන සෑම අවස්ථාවකදීම අලුත් ආවර්තයක් ආරම්භ වේ.
- එනම් අවසන් ශක්ති මට්ටම් අංකය එම මූලද්රව්ය පිහිටි ආවර්තයට සමාන වේ.
| ආවර්තයට අයත් උපශක්ති මට්ටම් | ආවර්තය | ආවර්තයට අයත් මූලද්රව්ය ගණන |
| 1s | 1 | 2 |
| 2s 2p | 2 | 8 |
| 3s 3p | 3 | 8 |
| 4s 3d 4p | 4 | 18 |
| 5s 4d 5p | 5 | 18 |
| 6s 4f 5d 6p | 6 | 32 |
| 7s 5f 6d 7p | 7 | 32 |
මූලද්රව්ය කාණ්ඩ වලට වෙන් කිරීම
- අවසාන ශක්ති මට්ටම / සංයුජතා කවචයේ සමාන ඉලෙක්ට්රෝන ගණනක් ඇති මූලද්රව්ය එකම කාණ්ඩයකට ගොනු කර ඇත.
උදා: සංයුජතා කවචයේ e 2 ක් ඇති මූලද්රව්ය දෙවන කාණ්ඩයට අයත් වේ.
- නූතන ආවර්තිතා වගුවේ සමාන රසායනයක් ඇති මූලද්රව්ය එකම කාණ්ඩයකට වර්ග කර ඇත.
| කාණ්ඩය | නාමය | මූලද්රව්ය |
| 1 | ක්ෂාර ලෝහ | Li,Na,K,Rb,Cs,Fr |
| 2 | ක්ෂාරීය පාංශු ලෝහ | Be,Mg,Ca,Sr,Ba,Ra |
| 16 | කැල්කොජන | O,S,Se,Te,Po |
| 17 | හැලජන | F,Cl,Br,I,At |
| 18 | උච්ච වායු ( විරල වායු) | Ne,Ar,Kr,Xe,Rn |
මූලද්රව්ය ගොනු වලට වෙන් කිරීම
- කාක්ෂික වල ඉලෙක්ට්රෝන පිළිවෙළ පදනම් කර ගෙන ආවර්තිතා වගුව තව දුරටත් ගොනු 4 කට බෙදේ.
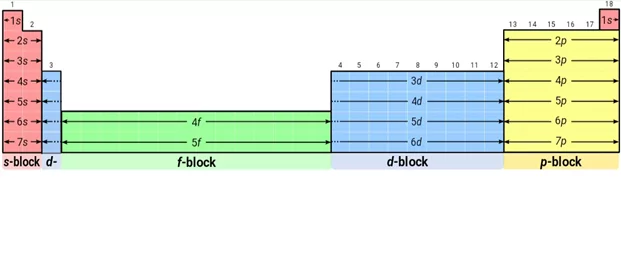
S ගොනුව
- සංයුජතා ඉලෙක්ට්රෝන s උප ශක්ති මට්ටමට ඇතුල් වීමෙන් සෑදෙන මූලද්රව්ය අයත් වේ.
- බොහොමයක් ලෝහ වේ.
- Be අලෝහ ගුණ පෙන්වයි .
1 කාණ්ඩයේ පොදු වින්යාසය – ns1 හෝ (n-1)p6 ns1
2 කාණ්ඩයේ පොදු වින්යාසය – ns2 හෝ (n-1)p6 ns2
P ගොනුව
- සංයුජතා ඉලෙක්ට්රෝන p උප ශක්ති මට්ටමට ඇතුල් වීමෙන් සෑදෙන මූලද්රව්ය අයත් වේ.
- He හැර 13 සිට 18 කාණ්ඩ දක්වා මූලද්රව්ය අයත් වේ.
- බහුතරය අලෝහ වේ.
S හා p ගොනුවල මූලද්රව්ය පොදුවේ නියෝජක මූලද්රව්ය ලෙසද ඇතැම් විට ප්රධාන කාණ්ඩ මූලද්රව්ය ලෙසද හදුන්වයි.
d ගොනුව
- සංයුජතා ඉලෙක්ට්රෝන d උප ශක්ති මට්ටමට ඇතුල් වීමෙන් සෑදෙන මූලද්රව්ය අයත් වේ.
- 3 සිට 12කාණ්ඩ දක්වා මූලද්රව්ය ඇත.
- 3 සිට 12 කාණ්ඩ මූලද්රව්ය හැර අනෙකුත් d ගොනු මූලද්රව්ය අන්තරික ලෝහ ලෙස හදුන්වයි .
f ගොනුව
- සංයුජතා ඉලෙක්ට්රෝන f උපශක්ති මට්ටමට ඇතුල් වීමෙන් සෑදෙන මූලද්රව්ය අයත් වේ.
- s හා d ගොනු අතර ඇති තීරු 14 කින් හා පේළි 2 කින් යුක්තය.
- මේම මූලද්රව්ය ඇතුළු අන්තරික මූලද්රව්ය ලෙස හදුන්වයි.
s හා p ගොනුවල මූලද්රව්ය පෙන්වන ආවර්තීය නැඹුරුතා
- පරමාණු වල ගුණ රැදී පවතින්නේ ඉලෙක්ට්රෝන වින්යාසය හා පරමාණුවේ බාහිර ඉලෙක්ට්රෝන න්යෂ්ටිය වෙතට කෙතරම් ආකර්ෂණය වී තිබේද යන්න මතය.
පරමාණුක අරය
- සාමාන්යයෙන් න්යෂ්ටිය හා ඉලෙක්ට්රෝන පවතින බාහිරතම ශක්ති මට්ටම් අතර දුර පරමාණුක අරය ලෙස සළකයි.
- එහෙත් ඉලෙක්ට්රෝනයක් පිහිටන ස්ථානය අවිනිශ්චිත බැවින් එහි ප්රතිඵලයක් ලෙස පරමාණුක අරය ප්රකාශ කිරීම අසීරුය.
- එබැවින් එය විවිධ ආකාරයට අර්ථ දක්වයි.
1.වැන්ඩවාල් අරය
- සර්වසම නිර්බන්ධිත පරමාණු දෙකක් හෝ අණු 2 ක් ඒවායේ වඩාත්ම ස්ථායී සකස් වීමේදී , එනම් ආකර්ශන බල උපරිම වන අවස්ථාවේ ඒවායේ න්යෂ්ටි අතර දුරෙන් අර්ධයක් වැන්ඩවාල් / නිර්බන්ධිත අරය ලෙස හදුන්වයි .
2.සහසංයුජ අරය ( බන්ධනය වූ පරමාණු 2 හි න්යෂ්ටි අතර දුරෙන් අඩකි.)
- එකම මූලද්රව්යයේ පරමාණු 2 ක් තනි සහබන්ධයකින් බැදී ඇති විට ඒවායේ න්යෂ්ටි අතර දුරින් හරි අඩක් සහසංයුජ අරය නම් වේ.
- O , O=O බන්ධනය සාදන බැවින් එහි සහසංයුජ අරය H2O2 ද , N , N ත්රිත්ව බන්ධන N ඇති බැවින් එහි සහසංයුජ අරය N2H4 ද සොයයි.
- ලෝහමය මූලද්රව්ය වායුමය අවස්ථාවේදී ද්වි පරමාණුක අණු සාදන බැවින් ඒවායේ සහසංයුජ අරයද පරීක්ෂණාත්මකව සොයා ඇත.
උදා: Na2 වායුව
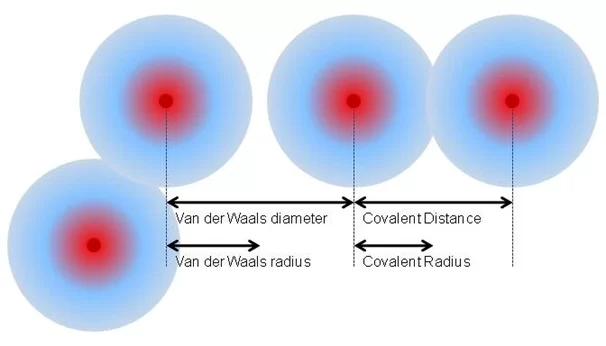
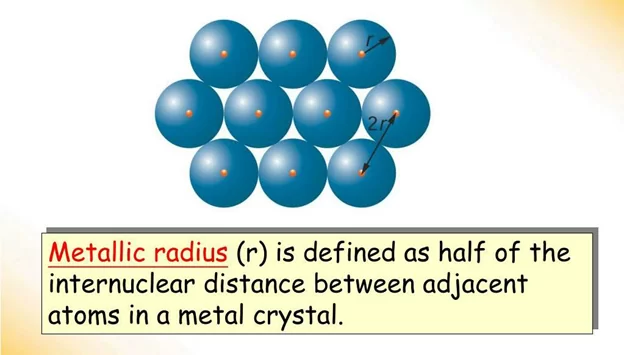
3.ලෝහක අරය
- ලෝහ ස්ඵටිකයක දැලිසක් තුළ යාබද කැටායන දෙකක න්යෂ්ටි අතර දුරින් හරි අඩක් ලෝහක අරය ලෙස හඳුන්වයි.
අරය රඳා පවතින සාධක
1.පරමාණුවක ඇති කවච ගණන
- කවච ගණන වැඩි වන විට අරය වැඩි වේ .
2.නිවාරක ආචරණය
- ඇතුළු කවච ඉලෙක්ට්රෝන මගින් සහ සහසංයුජ ඉලෙක්ට්රෝන (එනම් අවසාන කවචයේ ඇති ඉලෙක්ට්රෝන ) න්යෂ්ටියෙන් ඇති කරන ආකර්ශනයට බාධා පැමිණවීම හෝ අන්තර් ඉලෙක්ට්රෝන මගින් න්යෂ්ටිය ආවරණය කිරීම. මෙය වැඩි වන විට අරය වැඩි වේ .
- ඉලෙක්ට්රෝන සංඛ්යාව හා කවච සංඛ්යාව වැඩි වන විට නිවාරක ආචරණය වැඩි වේ.
3.සඵල න්යෂ්ටික ආරෝපණය
- න්යෂ්ටියේ ඇති ප්රෝටෝන මගින් ඉලෙක්ට්රෝන වලාව ආකර්ෂණයේ හා නිවාරක ආචරණයේ සමස්ත බලපෑමයි .
- න්යෂ්ටියේ ඇති ප්රෝටෝන ගණන වැඩි වීමත් සමඟ සමග න්යෂ්ටික ආකර්ෂණය වැඩිවේ . පරමාණුව කුඩා වී සහසංයුජ අරය අඩු වේ .
- ආවර්තිතා වගුවේ ඕනෑම ආවර්තයක වමේ සිට දකුණට, සඵල න්යෂ්ටික ආරෝපණය වැඩි වේ.
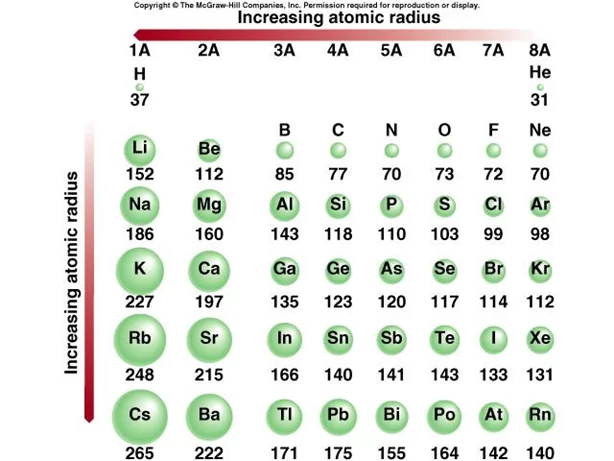
පරමාණුක අරයෙහි ආවර්තීය නැඹුරුතා
- එක් එක් කාණ්ඩ තුළ පරමාණුක අරය ඉහළ සිට පහළට වැඩිවේ.
- පහල මූලද්රව්ය පරමාණුවල ඉලෙක්ට්රෝන පවතින කවච /ශක්ති මට්ටම් (n) වැඩි වන නිසා අරය වැඩි වේ.
- පහලට සඵල න්යෂ්ටික ආරෝපණය අඩු වන නිසා නිවාරක ආචරණය වැඩි වේ .
- ආවර්තයක් තුළ සාමාන්යයෙන් වමේ සිට දකුණට පරමාණුක අරය අඩු වේ.
- මෙයට හේතුව සඵල න්යෂ්ටික ආරෝපණය වැඩි වීමයි. සඵල න්යෂ්ටික ආරෝපණය සංයුජතා ඉලෙක්ට්රෝන න්යෂ්ඨිය වෙත ඇද ගන්නා අතර, එය පරමාණුක අරය අඩු කරයි.
- ආවර්තයක් දිගේ කවච ගණන වෙනස් නොවේ. නිවාරක ආචරණය ද බොහෝ දුරට සමානයි.
අයන වල ඉලෙක්ට්රෝන වින්යාස
- පරමාණුවකින් ඉලෙක්ට්රෝන ඉවත් වී කැටායන සෑදීමේදී ඉලෙක්ට්රෝන බැහැර වන්නේ ඉහළම ප්රධාන ක්වන්ටම් අංකය(n) පිරී ඇති කාක්ෂික වලිනි.
උදා: Na 1s2 2s2 2p6 3s1 Na+ 1s2 2s2 2p6 + e–
- ඇනායනයක් සෑදීමේදී පරමාණුවකට ඉලෙක්ට්රෝන එකතු වන්නේ සංයුජතා කවචට අයත් හිස් හෝ භාගික ලෙස පිරුණු උපරිම n අගයෙන් යුත් කාක්ෂික වලටය.
උදා: F 1s2 2s2 2p5 + e F– 1s1 2s22p6
අයනික අරයේ ආවර්තීය නැඹුරුතා
- පරමාණුවක තරම සේම අයනික තරම ද එහි න්යෂ්ටික ආරෝපණය, එය දරණ ඉලෙක්ට්රෝන සංඛ්යාව සහ සංයුජතා ඉලෙක්ට්රෝන පවතින කාක්ෂික යන සාධක මත රැඳී පවතී .
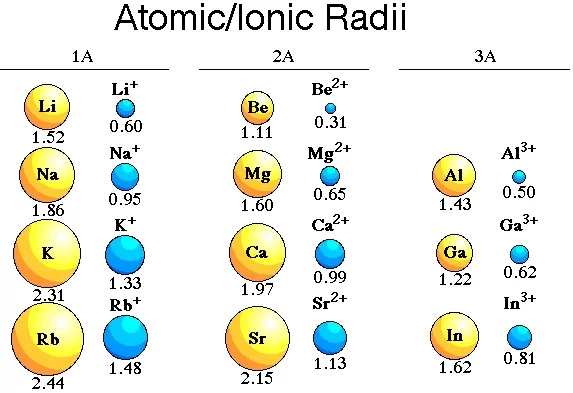
- කැටායනයක් සෑදීමේදී පරමාණුවකින් ඉලෙක්ට්රෝන ඉවත් වීම සිදුවේ. එම නිසා ඉලෙක්ට්රෝන – ඉලෙක්ට්රෝන විකර්ශනය අඩුවේ .
- එබැවින් ඒවායේ මව් පරමාණු වලට වඩා කැටායනය තරමින් කුඩා වේ.
- කැටායනයේ ආරෝපණය වැඩි වන විට අරය අඩු වේ.
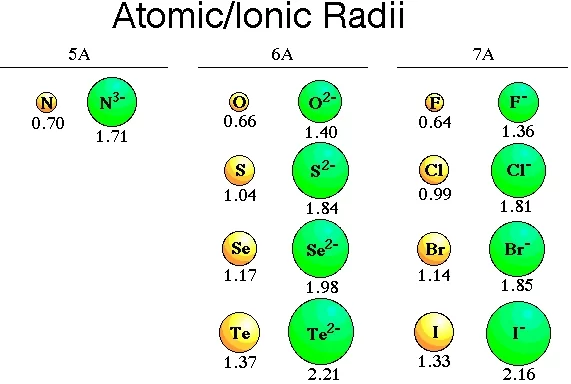
- ඇනායනයක් සෑදීමේදී පරමාණුවට ඉලෙක්ට්රෝන එකතුවේ එම නිසා එමනිසා එම නිසා ඉලෙක්ට්රෝන – ඉලෙක්ට්රෝන විකර්ශනය වැඩිවේ.
- එම නිසා ඒවායේ මව් පරමාණු වලට වඩා ඇනායනය තරමින් විශාල වේ.
- ඇනායනයේ ආරෝපණය වැඩි වන විට අරයද වැඩි වේ.
- එකම ඉලෙක්ට්රෝන වින්යාස ඇති උච්ච වායුවක් සහ කැටායනයක් සැලකූවිට කැටායනයේ අරය අඩු වේ.
- සමාන ආරෝපණ සහිත කැටායන සහ ඇනායන වල අයනික අරය කාණ්ඩය ඔස්සේ ඉහළ සිට පහළට වැඩි වේ.
- ආවර්තයක සියලුම කැටායන වලට වඩා සියලුම ඇනායන වල අරය වැඩි වේ.
උදා: 2 වන ආවර්තයේ විශාලතම අයනික අරය නයිට්රජන් සතුවේ .
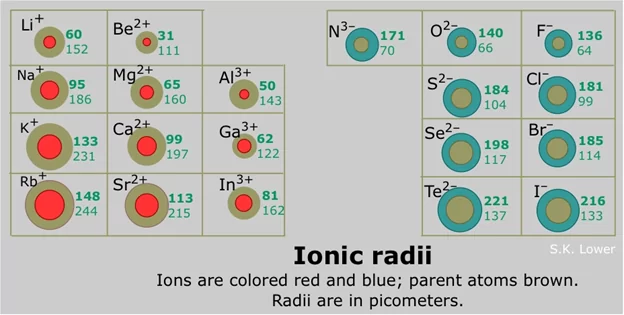
සම ඉලෙක්ට්රොනික ශ්රේණියක් යනු සමාන ඉලෙක්ට්රෝන සංඛ්යාවක් දරණ විශේෂ සමූහයකි.
උදා: O2- , F– , Ne , Na+ , Mg2+ යන සම ඉලෙක්ට්රොනික ශ්රේණියෙහි සියල්ලෙහි ම මුළු ඉලෙක්ට්රෝන සංඛ්යාව 10 ක් වේ.
ඕනෑම සම ඉලෙක්ට්රොනික ශ්රේණියක පරමාණුක ක්රමාංකය වැඩිවීමත් සමග න්යෂ්ටික ආරෝපණය වැඩි වෙයි .
ඉලෙක්ට්රෝන සංඛ්යාව නියතව පවත්නා බැවින් න්යෂ්ටික ආරෝපණයේ වැඩිවීමත් සමඟ ඉලෙක්ට්රෝන වඩ වඩා ප්රබල ලෙස න්යෂ්ඨිය වෙත ආකර්ෂණය කෙරෙන බැවින් අයනික අරය අඩු වේ .
අයනීකරණ ශක්තිය
- භූමි අවස්ථාවේ ඇති හුදකලා වායුමය පරමාණුවකින් හෝ අයනයකින් ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට අවශ්ය අවම ශක්තිය අයනීකරණ ශක්තිය නම් වේ මෙය KJmol-1 ඒකකයෙන් ප්රකාශ කරයි.
- පළමු අයනීකරණ ශක්තිය (I1 ) – උදාසීන වායුමය පරමාණුවකින් ඊට ලිහිල්වම බැඳී ඇති ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට අවශ්ය අවම ශක්තිය.
Li (g) → Li+(g) + e–
- දෙවන අයනීකරණ ශක්තිය (I2 ) – වායුමය ඒක සංයුජ කැටායනයකින් ඊට ලිහිල්වම බැඳී ඇති ඉලෙක්ට්රෝනයක් ඉවත් කර වායුමය ද්වි සංයුජ කැටායනයක් සෑදීමට අවශ්ය අවම ශක්තිය.
Li+ (g) → Li2+ (g)+ e–
- අනුයාත ඉලෙක්ට්රෝන ඉවත් වීමත් සමග I3 > I2 > I1 ලෙස අයනීකරණ ශක්ති ආරෝහණය වේ.
- හේතුව – අනුයාත ඉලෙක්ට්රෝන ඉවත් වන විට පරමාණුවේ + ධන ආරෝපණය වැඩි වේ. න්යෂ්ටියේ ඇතුළු කවච වල ඉලෙක්ට්රෝවල ඉලෙක්ට්රෝන කෙරෙහි දක්වන ආකර්ෂණය මැඩ පවත්වා තවදුරටත් ඉලෙක්ට්රෝන ඉවත් කර ගැනීමට යෙදිය යුතු ශක්තිය ක්රමයෙන් වැඩි වේ.
අයනීකරණ ශක්තිය කෙරෙහි බලපාන සාධක
1.පරමාණුක අරය – අරය අඩු වන විට ඉලෙක්ට්රෝන න්යෂ්ඨිය කෙරෙහි දක්වන ආකර්ෂණය වැඩිවේ.
මෙම ආකර්ෂණය වැඩි වන විට ඉලෙක්ට්රෝන බැහැර කිරීම අපහසු බැවින් අයනීකරණ ශක්තිය වැඩිවේ.
2. ඉලෙක්ට්රෝන වින්යාසය – ස්ථායි ඉලෙක්ට්රෝන වින්යාස පවතින මූලද්රව්යයකින් ඉලෙක්ට්රෝනයක් ඉවත් කිරීම සඳහා ලබා දිය යුතු අයනීකරණ ශක්තිය වැඩිවේ.
3.සඵල න්යෂ්ටික ආරෝපණය – වැඩි වන විට අයනීකරණ ශක්තිය වැඩි වේ.
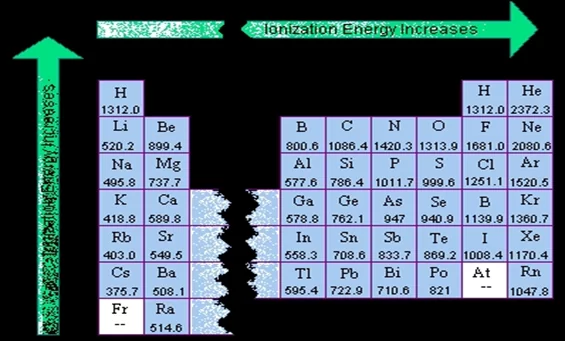
පළමු අයනීකරණ ශක්ති වල ආවර්තීය නැඹුරුතා
- සාමාන්යයෙන් ආවර්තයක් ඔස්සේ පළමු අයනීකරණ ශක්තිය වැඩිවේ.
- ආවර්තයක උපරිම පළමු අයනීකරණ ශක්තිය උච්ච වායු වලට පවතින අතර අවම පළමු අයනීකරණ ශක්තිය ක්ෂාර ලෝහ සතුය.
- ආවර්තිතා වගුවේ කවර හෝ කාණ්ඩයක පහලට යන විට සාමාන්යයෙන් පළමු අයනීකරණ ශක්තිය අඩු වේ.
උදා: පලවන කාණ්ඩයේ ක්ෂාර ලෝහ වල
Li > Na > K > Rb > Cs > Fr
ඉලෙක්ට්රෝන ලබා ගැනීමේ ශක්තිය (EG)
- වායුමය පරමාණුවකට ඉලෙක්ට්රෝනයක් එක් කිරීමේදී සිදුවන ශක්ති විපර්යාසයයි.
- බොහෝ පරමාණු වලට ඉලෙක්ට්රෝන එක් කිරීමේදී ශක්තිය පිට වේ.
- පරමාණු ස්වල්පයක් සඳහා ඉලෙක්ට්රෝන ලබා ගැනීමේ ශක්ති වෙනස ධන අගයකි.
උදා: Be – s2 හා N – p3 වැනි සාපේක්ෂව ස්ථායි ඉලෙක්ට්රෝන වින්යාසයකට ඉලෙක්ට්රෝනයක් එකතු කිරීම තරමක් අපහසු වේ. එහිදී ඉලෙක්ට්රෝන – ඉලෙක්ට්රෝන අතර විකර්ෂණ බල ප්රමුඛ වේ.
- ආවර්තයක් හරහා ඉලෙක්ට්රෝන ලබා ගැනීමේ ශක්තියෙහි ධන අගය අඩු වන අතර කාණ්ඩයක් දිගේ පහලට යන විට එම අගය වඩා ධන වේ.
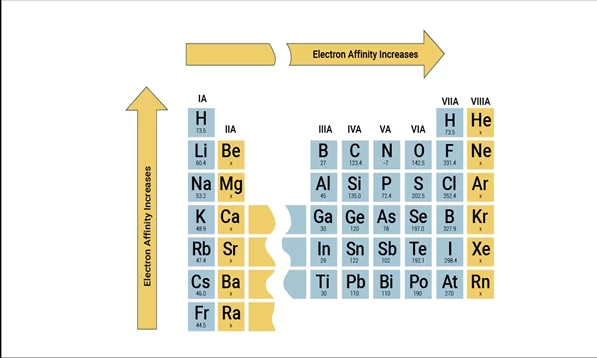
ඉලෙක්ට්රෝන බන්ධුතාවය (EA)
- ඉලෙක්ට්රෝන බන්ධුතාව යනු මූලද්රව්යයේ වායුමය ඇනායනයකින් ඉලෙක්ට්රෝනයක් ඉවත් කිරීමේ දී සිදුවන ශක්ති වෙනසයි.
- පරමාණුක ඉලෙක්ට්රෝන බන්ධුතාව ඉලෙක්ට්රෝන ලබා ගැනීමේ ශක්ති අගයට කිට්ටු සම්බන්ධයක් තිබේ.
- මෙම ශක්ති වෙනස ඉලෙක්ට්රෝන ලබා ගැනීමේ ශක්ති අගයට විශාලත්වයෙන් සමාන වන අතර ලකුණින් ප්රතිවිරුද්ධ වේ.
- ආවර්තයක් හරහා ඉලෙක්ට්රෝන බන්ධුතාව වඩාත් ධන වන අතර කාණ්ඩයක් දිගේ පහළට ධන අගය අඩුවේ.
- පළමු ඉලෙක්ට්රෝන බන්ධුතාව සඳහා විශාලතම ඍණ අගයක් ඇත්තේ ක්ලෝරීන් ( Cl) වලටය.
- ඉලෙක්ට්රෝන බන්ධුතාව යෙදී බාහිර මට්ටමට ඉලෙක්ට්රෝන එකතු වීමේදී එකතුවීමේදී අනෙක් ඉලෙක්ට්රෝන සිදු කරනු ලබන විකර්ෂණය මැඩ පැවැත්වීමට කළ යුතු කාර්යයේත් ඇනායනය සෑදීමේදී මුදාහරින ශක්තියේ වීජීය එකතුව වේ. ක්ලෝරීන් (Cl) වල අරයට වඩා ෆ්ලෝරීන් (F) වල අරය කුඩා බැවින් විකර්ශන වැඩි නිසා ක්ලෝරීන් වල පළමු ඉලෙක්ට්රෝන බන්ධුතාව ෆ්ලෝරීන් වලට වඩා ඉහළ ඍණ අගයකි.
- උච්ච වායු වල ප්රථම ඉලෙක්ට්රෝන බන්ධුතාව ධන අගයකි.
- හැලජන ඉතා ඉහළ පළමු ඉලෙක්ට්රෝන බන්ධුතා ඍණ අගයක් පෙන්වයි.
හේතුව – ඉලෙක්ට්රෝනයක් ලබා ගැනීමේදී ස්ථායි වින්යාසයක් ලැබෙන බැවිනි .
- සෑම මූලද්රව්යයක ම දෙවන ඉලෙක්ට්රෝන බන්දුතාවය ධන අගයක් වේ.
හේතුව – පවතින සෘණ ශ්රේෂ්ත්රය මගින් බාහිරින් පැමිණෙන ඉලෙක්ට්රෝන විකර්ෂණය කිරීම.
විද්යුත් ඍණතාව
- අනුවක පවතින බන්ධනයක දී ඉලෙක්ට්රෝන තමා දෙසට ආකර්ෂණය කර ගැනීමේ හැකියාව ප්රමාණාත්මකව ප්රකාශ කළ විට විද්යුත් ඍණතාවය ලෙස හඳුන්වයි.
- පරමාණුවක විද්යුත් ඍණතාව වැඩි වන තරමට, එහි ඉලෙක්ට්රෝන ආකර්ෂණය කිරීමේ හැකියාවද වැඩිය.
- විද්යුත් ඍණතාව ප්රකාශ කිරීමේ ප්රථම හා බහුලව භාවිතා කරනුයේ පෝලිං විද්යුත් ඍණතා පරිමාණයයි.
- ආවර්තිතා වගුවේ වමේ සිට දකුණට සාමාන්යයෙන් විද්යුත් සෘණතාවය වැඩි වේ. නමුත් අපගමනයන් ද සිදුවේ.
- සාමාන්යයෙන් කාණ්ඩයක් දිගේ පහළට විද්යුත් ඍණතාවය අඩුවේ.
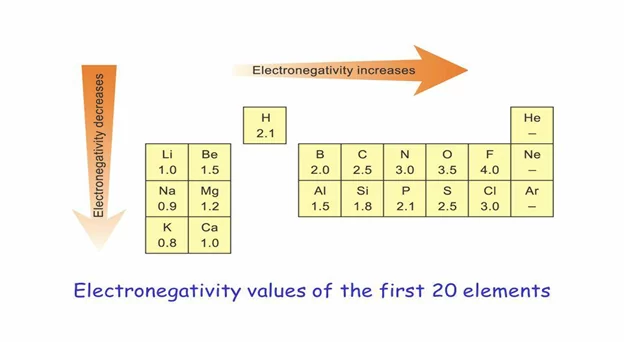
- පෝලිං පරිමාණයට අනුව වැඩිම විද්යුත් ඍණතාවය FONCl පෙන්වයි.
F > O > N > Cl
විද්යුත් ඍණතාවය රඳා පවතින සාධක ,
1.ඔක්සිකරණ අංකය හා ආරෝපණය
ඔක්සිකරණ අංකය වැඩි වන විට විද්යුත් ඍණතාවය වැඩිවේ.
උදා: NH4+ > NH3 > NH2—
කැටායනයක ආරෝපණය වැඩි වන විට පරමාණුවට වඩා අරය අඩු වී ඔක්සිකරණ අංකය වැඩි වී විද්යුත් ඍණතාව වැඩිවේ.
උදා: Fe 1.8
Fe2+ 1.83
Fe3+ 1.96
ඇයනයක ආරෝපණය වැඩි වන විට විද්යුත් ඍණතාව අඩු වේ.
උදා: F 4
F– 0.8
2. මුහුම්කරණ වර්ගය
s ලක්ෂණ වැඩි වන විට විද්යුත් ඍණතාව වැඩි වේ.
sp > sp2 > sp3
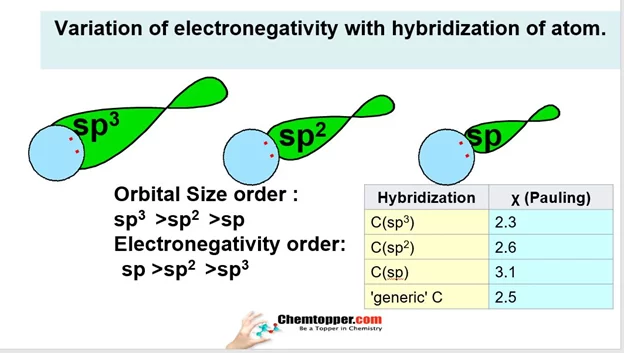
3. එම පරමාණුවේ පරිසරය හා අරය මත ද මතද විද්යුත් ඍණතාව රදා පවතී. අරය වැඩි වන විට විද්යුත් ඍණතාව අඩුවේ.
අයනීකරණ ශක්තිය මත ද විද්යුත් සෘණතාව රඳාපවතින අතර අයනීකරණ ශක්තිය වැඩි වන විට ඉලෙක්ට්රෝන පිට කිරීමට වැඩි කැමැත්තක් නොදක්වන අතර විද්යුත් ඍණතාව වැඩිවේ.
Video Links:






ගොඩක් ස්තූතිය මේ කරන උපකාරයට.නොදන්න කරුණු ගොඩාක් ඉගෙන ගත්තා.