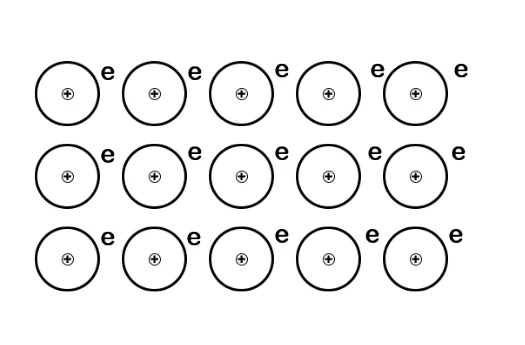
- ලෝහ විද්යුත් ධන වේ. එමනිසා ලෝහ ස්ථායි වීම සදහා සංයුජතා ඉලෙක්ට්රෝන ඉවත්කර ධන අයන සාදයි.
- ඉවත්කරන ඉලෙක්ට්රෝන මගින් ඉලෙක්ට්රෝන වලාවක් සෑදේ.ධන අයන ඒ තුල ගිලී පවතී.
- මෙම ඉලෙක්ට්රෝන හා ධන යන අතර ඇතිවන ප්රබල ස්ථීති විද්යුත් ආකර්ෂණ බල ලෝහක බන්ධන ලෙස හැදින්වේ.
මෙම ඉලෙක්ට්රෝන වලාව සචල වන අතර එම ඉලෙක්ට්රොන මුක්ත/නිදහස් ඉලෙක්ට්රෝන ලෙස හදුන්වයි.
ලෝහක බන්ධනයක ප්රබලතාව කෙරෙහි බලපාන සාධක
ලෝහක බන්ධනය නිර්මාණය වීමට පරමනුවකින් සපයන ඉලෙක්ට්රෝන සංඛ්යාව වැඩිවන විට,
- ඉලෙක්ට්රෝන වලාවේ ඝනත්වය වැඩිවේ.
- කැටායන හා ඉලෙක්ට්රෝන වලව අතර ආකර්ෂණය වැඩිවේ.
- ලෝහක ප්රබලතාව වැඩිවේ.
අයනික අරය
- ධන අයන විශාල විමෙන් ඉලෙක්ට්රෝන වලාවේ ඝනත්වය අඩුවේ.
- ඉලෙක්ට්රෝන හා කැටායන අතර ආකර්ෂණය අඩුවේ.
- ලෝහක බන්ධනයේ ප්රබලතාවය අඩුවේ.
අයනික ස්වාභාවය.
- අයනික ස්වභාවය යනු ලෝහක බන්ධනයට ඉලෙක්ට්රොන සැපයීමට ඇති නැඹුරුතාවයයි.
- අයනීකරණ ශක්තිය වැඩිවන විට ඉලෙක්ට්රෝන සැපයීමේ ප්රවනතාව අඩුවේ.
- අයනික ස්වභාවය අඩුවේ.
- ඉලෙක්ට්රෝන වලාව දුර්වල වේ.
- ලෝහක බන්ධනයේ ප්රබලතාව අඩුවේ.
ක්ෂාර ලෝහ හා ක්ෂාරීය පාංශු ලෝහ සදහා මෙය බලපෑමක් නොවේ. නමුත් ආන්තරික ලෝහ කෙරෙහි අනිවාර්යයෙන්ම බලපායි.
ලෝහවල ගුණ
- කාමර උෂ්ණත්වයේදී ඝන ලෙස පවතී
- ඉහල ද්රවාංකයක් හා තාපාංකයක් පවතී.
ලෝහක ජාල බිදීමට ඉතා විශාල අමතර ශක්තියක් අවශ්ය වේ. එමනිසා මේවායේ ද්රවාංක හා තාපාංක ඉහල අගයන් ගනී.
- ඉතා හොද තාප සන්නායක වේ.
ලෝහ අග්රයට තාපය සැපයු විට එම අග්රයේ කැටායන වල කම්පන ශක්තිය වැඩිවේ. නිදහස් සචල ඉලෙක්ට්රෝන හරහා එම ශක්තිය ඊළග කැටායනයට ගමන් කරයි. මෙලෙස තාපය සන්නයනය වේ.
- ඉතා හොද විද්යුත් සන්නායක වේ.
ලෝහක ජාලයේ පවතින මුක්ත ඉලෙක්ට්රෝන මගින් විද්යුතය සන්නයනය කරයි.
- තැලෙන සුළු බව හා ඇදෙන සුළු බව (තන්ය හා ආහන්ය)
ලෝහයකට බලයක් යෙදු විට එම කැටායන අනෙකුත් කැටායන අතරට යයි. ඉලෙක්ට්රෝන වලාවද ඒ අනුව සැකසේ. එමනිසා ලෝහක බන්ධනය වෙනස් නොවී ලෝහය ඇදේ. මෙයට උපරිම සීමාවක් ඇත.
- ලෝහක දිස්නය.
ලෝහයක් මතට ආලෝකය පතිත වූ විට එහි සචල ඉලෙක්ට්රොන මගින් ආලෝකය අවශෝෂණය කරයි. එය නැවත විමෝචනය වන විට ලෝහක දිස්නයක් ඇතිවේ.
කාණ්ඩ අනුව ලෝහක ලක්ෂණ විචලනය
ක්ෂාර ලෝහ වලට වඩා ක්ෂාරීය පාංශු ලෝහ වල ඉහත ගුණ ප්රබල වේ.
- ලෝහක බන්ධන සැදීමේදී ක්ෂාර ලෝහ වල ns1 ඉලෙක්ට්රෝනද, ක්ෂාරීය පාංශු ලෝහ වල ns2 ඉලෙක්ට්රෝනද සහබාගි වේ.
- එමනිසා ක්ෂාර ලෝහ වලට වැඩ ක්ෂාරීය පාංශු ලෝහ වල නිදහස් ඉලෙක්ට්රෝන සංඛ්යාව වැඩිය.
- එමනිසා ඉහත සාධක ප්රබල වේ.
s ගොනුවේ ලෝහ වලට වඩා d ගොනුවේ ලෝහවල ඉහත ගුණ ප්රබල වේ.
- ලෝහක බන්ධන සෑදීමේදී S ගොනුවේ ලෝහ වලින් ns හා d ගොනුවේ ලෝහවලින් ns ඉලෙක්ට්රෝන වලට අමතරව (n-1)d ඉලෙක්ට්රෝන ද සහබාගි වේ.
- එවිට d ගොනුවේ ලෝහ වල නිදහස් සචල ඉලෙක්ට්රෝන සංඛ්යාව වැඩිවන බැවින් ඉහත ගුණ ප්රබල වේ.





