සහසංයුජ අණු දෙකක් අතර වූ සහ සහසංයුජ අණුවක් හා අයනයක් අතර ගොඩනැගෙන්නාවූ රසායනික අන්තර් ක්රියා විශේෂ වේ.
මේවා අණුව තුළ පවතින අයනික, දායක සහ සහසංයුජ වැනි ප්රාථමික බන්ධන තරම් ප්රබල නැත.
මේවා; ද්විතීක බන්ධන, අන්තර් අණුක ආකර්ෂණ බල වැන්ඩ’වාල් අන්තර් ක්රියා ලෙස ද හඳුන්වයි.
මේවා සාදාගන්නා ආකාරය අනුව වර්ග 5යි.
- අයන ද්වීධ්රැව අන්තර් ක්රියා
- ද්වීධ්රැව ද්වීධ්රැව අන්තර් ක්රියා හා හයිඩ්රජන් බන්ධන
- අයන ප්රේරිත ද්විධ්රැව අන්තර් ක්රියා
- ද්වීධ්රැව ප්රේරිත ද්වීධ්රැව අන්තර් ක්රියා
- ලන්ඩන් අපකිරණ බල
වැන්ඩවාල්ස් බල
මේවා අණුක ප්රභේද අතර හෝ එකම අණුක කාණ්ඩ අතර ක්රියාත්මක වන ආකර්ෂණ /විකර්ෂණ බලයි.
- ද්වීධ්රැව ද්වීධ්රැව අන්තර්ක්රියා
- ද්වීධ්රැව ප්රේරිත ද්වීධ්රැව අන්තර්ක්රියා
- ලන්ඩන් අපකිරණ බල ඊට ඇතුළත් වේ
අයන ද්වීධ්රැව අන්තර් ක්රියා
කැටායනයක් / ඇනායනයකට ධ්රැවීය අණුවක් ආකර්ෂණය වීමේදී අයනයේ ආරෝපණයට ප්රතිවිරුද්ධ ලෙස ද්වීධ්රැවයේ ඇති අග්රය සමඟ මේ ආකාරයේ අන්තර්ක්රියා හටගනී.
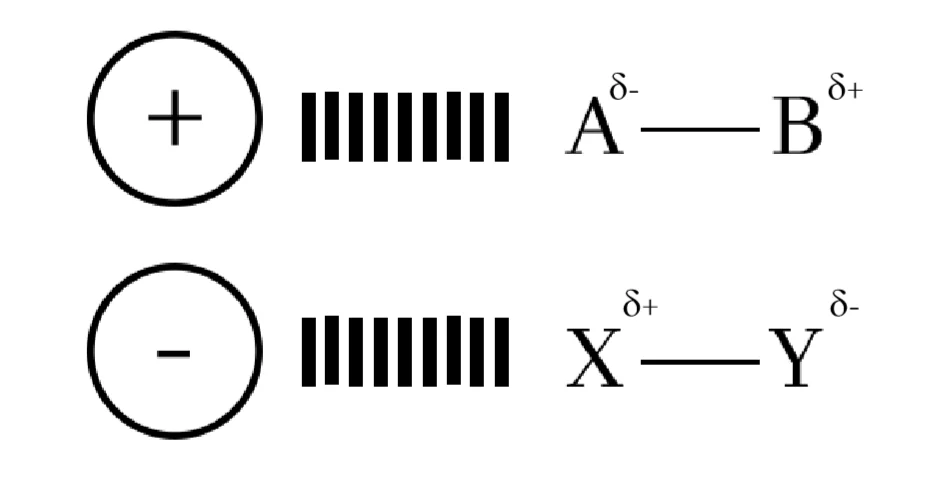
මෙම ආකර්ෂණ බලය ප්රබලතාවය;
- ද්වීධ්රැවයේ ස්වභාවය
- අයනයේ ආරෝපණය
- අයනයේ අරය මත රඳා පවතී.
උදාහරණ :-
NaCl වැනි අයනික සංයෝග ජලයට දැමූ විට Na+ හා Cl– අයන නිදහස් වී ඒවා ජලය සමඟ මෙම ආකර්ෂණ බල සාදා ගනී.
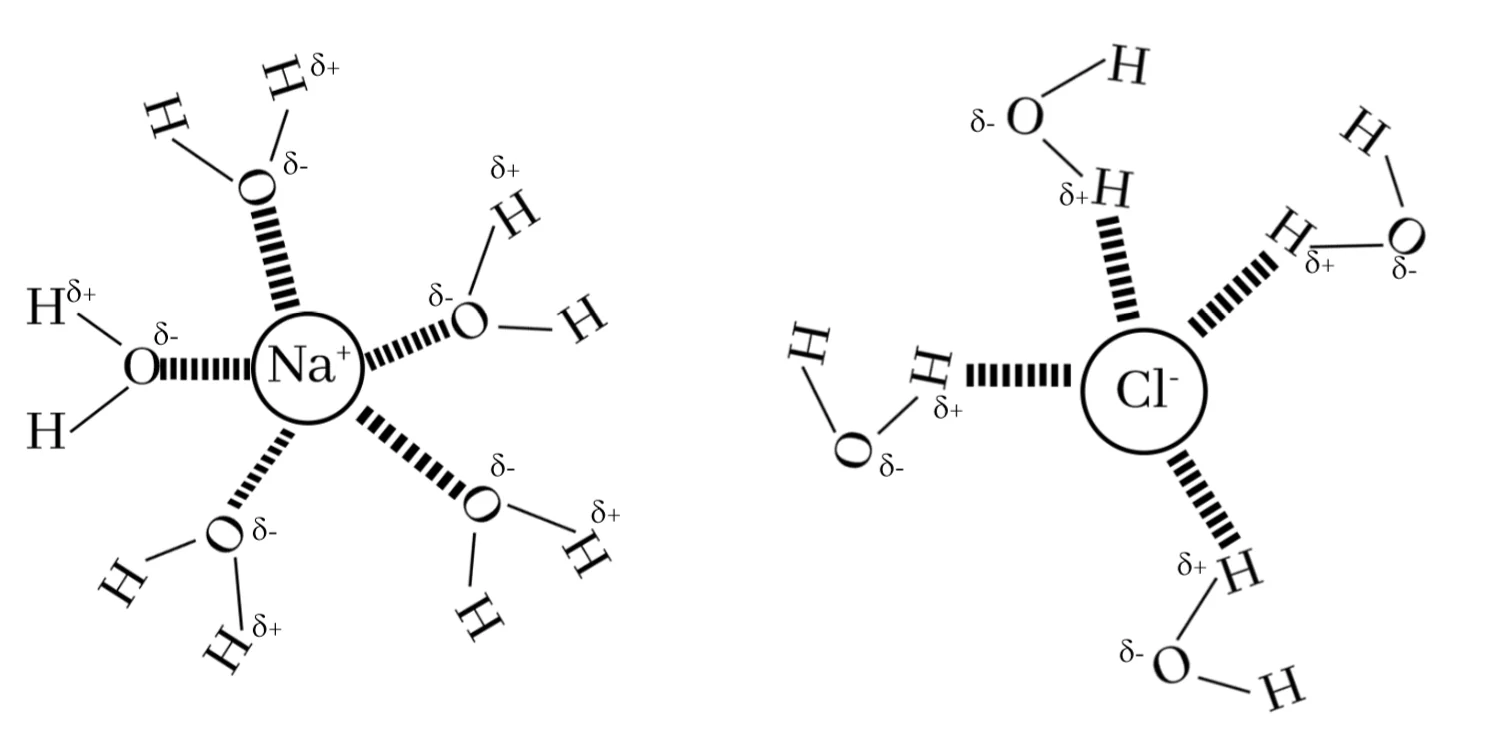
මෙම ආකර්ෂණ බලයේ ප්රබලතාවය අනුව + හා – අයන ජලයේ සජලනයේදී බාහිරයට තාපය පිට කරයි.
Eg:- Na+ අයන සජලනයේදී පිටකරන තාප ප්රමාණයට වඩා වැඩි තාප ප්රමාණයක් Al3+අයන සජලනයේදී පිටවේ.
(Al3+ හි ආරෝපණය වැඩි. අරය අඩුයි. ؞ ආකර්ෂණ බල ප්රබලතාවය වැඩියි.)
අයන ප්රේරිත ද්වීධ්රැව අන්තර් ක්රියා
ආරෝපිත අයන හා නිර්ධ්රැවීය අණු අතර ගොඩනැගෙන ආකර්ෂණ බලයි.
+/- ලෙස ආරෝපිත අයනයක් ධ්රැව ප්රේරණය වීමත් රහිත නිර්ධ්රැවීය අණුවකට ආසන්න වූ විට එම අණුවෙහි ඉලෙක්ට්රෝන වලාව මත ආකර්ෂණ / විකර්ෂණ බල ඇතිකිරීමේ ප්රතිඵලයක් ලෙස ඒ මත ධ්රැව ප්රේරණය වේ.
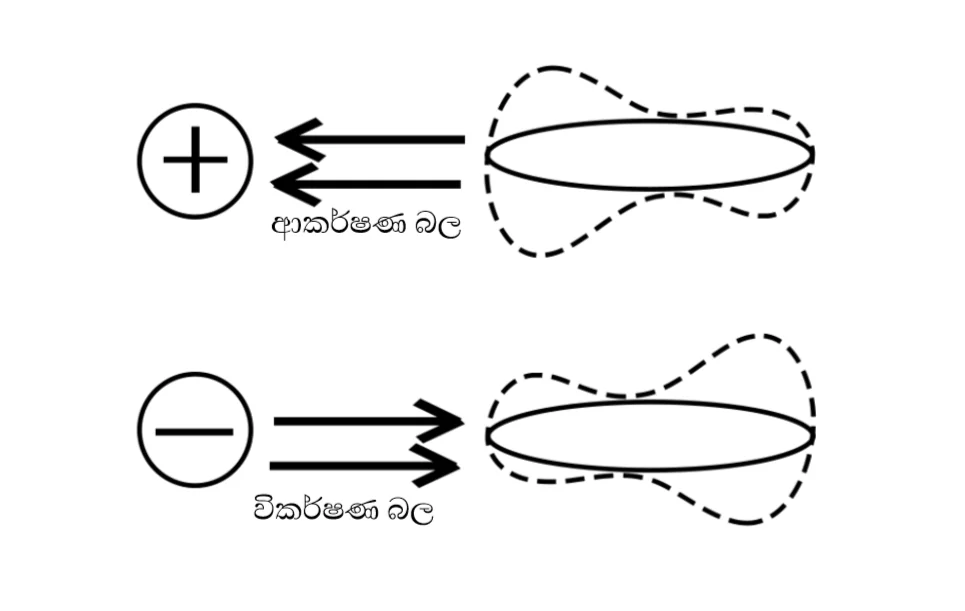
ආරෝපිත අයන හා ප්රේරිත ද්විධ්රැව වලින් සමන්විත නිර්ධ්රැවීය අණුවක ප්රතිවිරුද්ධ ආරෝපිත ධ්රැවයක් අතර ගොඩනැගෙන්නා වූ ආකර්ෂණ බල විශේෂය, අයන-ප්රේරිත ධ්රැව අන්තර්ක්රියා වේ.
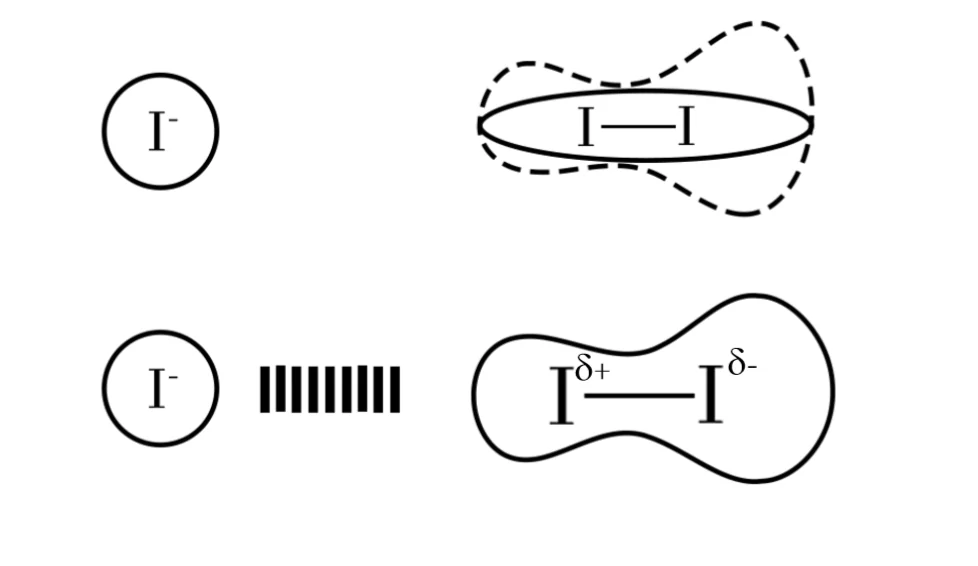
උදාහරණ :-
I2 , නිර්ධ්රැවීය නිසා ජලය තුල දිය වන්නේ ඉතා මද වශයෙනි. එහෙත් ජලීය KI තුළ ඝන අවස්ථාවේ වූ I2 දියවේ. මෙහිදී , I– ට I2 ළඟාවීමේදී අණුවේ e වලාව අසමමිතික වී ප්රේරිත ද්වධ්රැවයක් හටගනී.
මෙහි δ+ අග්රය හා I– අතර මෙම ආකර්ෂණ බලය ඇති වීමෙන් රතු-දුඹුරු පැහැති I3– සෑදෙයි.
ද්වීධ්රැව-ප්රේරිත ද්වීධ්රැව අන්තර් ක්රියා
ධ්රැවීය අණු හා නිර්ධ්රැවීය අණු (හෝ පරමාණු ) අතර ගොඩනැඟෙන බල විශේෂයයි.
නිර්ධ්රැවීය අණුවකට ස්ථිර ද්වීධ්රැවයක් ළඟා වූ විට, ස්ථිර ද්වීධ්රැවය නිසා නිර්ධ්රැවීය අණුව ප්රේරිත ද්වීධ්රැවයක් බවට පත්වෙයි. දැන්, මෙම ස්ථිර ද්වීධ්රැවයේ හා ප්රේරිත ද්වීධ්රැවයේ ප්රතිවිරුද්ධ අග්ර අතර මෙම අන්තර්ක්රියා හටගනී.
මේවා, ඉතා දුර්වල අන්තර්අණුක බල වේ.
ධ්රැවීය අණුවේ ද්වීධ්රැවයේ ඇති ස්ථිති විද්යුත් බල හේතුවෙන් නිර්ධ්රැවීය අණුවේ / පරමාණුවේ eවලාව ධ්රැවීකරණය වීමෙන් ඇතිවේ.

ප්රේරිත ද්විධ්රැවයේ ද්වීධ්රැව ඝූර්ණයේ අගය;
- නිර්ධ්රැවීය අණුවේ / පරමාණුවේ ධ්රැවණශීලිතාවය
- ධ්රැවීය අණුවේ ද්වීධ්රැව ඝූර්ණය මත රඳා පවතී.
උදාහරණ :-
- Ar පරමාණුව හා HCl අණුව අතර
- Xe , O2 , CO2 , F2 වැනි නිර්ධ්රැවීය වායු ජලය දියවීම.
ලන්ඩන් අපකිරණ බල ( ක්ෂණික ද්වීධ්රැව – ප්රේරිත ද්වීධ්රැව අන්තර් ක්රියා)
නිර්ධ්රැවීය සංයෝග වල දී එම අණු එකිනෙක රඳවා ගනු ලබන්නේ එම අණු අතර හටගන්නා ඉතා දුර්වල අන්තර්ක්රියා විශේෂයක් මගිනි. ඝන , ද්රව , වායු අවස්ථාවේ දී නිෂ්ක්රීය මූල ද්රව්ය ආශ්රිතව මෙවැනි දුර්වල අන්තර් ක්රියා ඇත. මේවා ලන්ඩන් අපකිරණ බල වේ.
උච්ඡ වායු වැනි නිර්ධ්රැවීය අණුවල න්යෂ්ටිය වටා e වලාව සමමිතිකව පවතින්නේ යැයි උපකල්පනය කළද , මෙම e වලාව චලනයේදී අසමමිතික විය හැක.
එවිට e ඝනත්වය පිහිටීම අනුව , අණුව තුළ තාවකාලික ද්වීධ්රැවයක් ස්වයංප්රේරණය විය හැක.
මෙසේ e වලාව විකෘති වීමෙන් හටගත් තවකාලික ද්වීධ්රැවයට වෙනත් නිර්ධ්රැවීය අණුවක් ළඟාවීමේ දී එයද තාවකාලිකව ධ්රැවීය විය හැක. එවැනි තාවකාලික ද්වීධ්රැව දෙකක ප්රතිවිරුද්ධ ආරෝපිත අග්ර අතර සාදාගන්නා අන්තර් අණුක ආකර්ෂණ බල, අපකිරණ බල නම් වේ.
මේවා හටගන්නේ තවකාලික ද්වීධ්රැව දෙකක් අතර නිසා මෙම ආකර්ෂණ බලය ක්ෂණිකව ඇතිවී නැතිවී යන දුබල ආකර්ෂණ බලයක් වේ.
නමුත් ස්වභාවයේ සුලභව දැකිය හැකි ආකර්ෂණ බලය මෙය වේ.
ධ්රැවීය වුවද , නිර්ධ්රැවීය වුවද සියලු ආකාර පරමාණු හා අණු අතර ලන්ඩන් බල පවතී.
විශාල අණුක ස්කන්ධ සහිත අණුවල භෞතික ගුණ නිර්ණයේදී මෙම අපකිරණ බල, ද්වීධ්රැව – ද්වීධ්රැව බල වලට වඩා වැදගත්ය.
උදා:-
| ද්විතීක බන්ධන වර්ගය | (oC) | |
| CH3F | අපකිරණ බල + ද්වීධ්රැව – ද්වීධ්රැව අන්තර්ක්රියා | -142 |
| CCl4 | අපකිරණ බල පමණයි | -23 |
CCl4 හි අපකිරණ බලවල ප්රබලතාවය,CH3F හි ද්වීධ්රැව – ද්වීධ්රැව අන්තර්ක්රියාද ඉක්මවා යන නිසා CCl4 හි ද්රවාංකය CH3F ට වඩා වැඩිවී ඇත.
අපකිරණ බලවල ප්රබලතාවයට බලපාන සාධක
- අණු අතර දුර
අණු අතර දුර වැඩිවීමත් සමග ආකර්ෂණ බල සාදාගැනීමේ හැකියාව අඩු වේ.
- අණුවේ ක්ෂේත්රඵලය
අණුවේ ක්ෂේත්රඵලය වැඩිවීමත් සමඟ e වලාව අසමමිතික විය හැකි ස්ථාන වැඩි නිසා අපකිරණ බලවල ප්රබලතාව වැඩි වේ.
- සාපේක්ෂ අණුක ස්කන්ධය
සාපේක්ෂ අණුක අණුක ස්කන්ධය වැඩියවත්ම ඝනත්වය වැඩි වී අසමමිතික වීම වැඩිවී අපකිරණ බල වල ප්රබලතාවය වැඩිවේ.
- අණුවේ හැඩය
දිගින් වැඩි අණුවල වඩා පහසුවෙන් ධ්රැවීකරණයට හා විස්ථාපනයට පාත්ර වේ.
උදා :- n-පෙන්ටේන් 360C දී නටන අතර නියෝ-පෙන්ටේන් නටන්නේ 900C දීය.
- අණු අතර ආකර්ෂණය වැඩිවත්ම තාපාංකය ඉහළ යයි.
- n-පෙන්ටේන්හි ලන්ඩන් බල, නියෝ-පෙන්ටේන්හි ලන්ඩන් බල වලට වඩා ප්රබල වේ.
- මෙයට හේතුව , නියෝ-පෙන්ටේන් අණුව සාපේක්ෂව ගෝලාකාර වීම හා එහි C-C බන්ධනවල සංයුජතා e , CH3 කාණ්ඩ මගින් හොඳින් ආවරණය වී තිබීමත් , n-පෙන්ටේන් දාමාකාර ආකාර අණුවක් වී එහි වූ එම C-C බන්ධනවල සංයුජතා e ලන්ඩන් බල ඇතිවීමට හැකි පරිදි වඩා නිරාවරණය වී තිබීම විය යුතුය.
ඝන අවස්ථාවේ I2 අණුවල ක්රමවත් ඇසිරීම , සම්බන්ධයෙන් වඩාත් ප්රමුඛ ආකර්ෂණ බල වන්නේ ලන්ඩන් බලයි.
- I2 යනු නිර්ධ්රැවීය අණුවකි. I2(s) අණුක ස්කන්ධය ස්ඵටිකයක් ලෙස සැලකේ. මෙය බරින් වැඩි විශාල අණුවකි.
- I2 අණුවල අණුක චරිතය සඳහා කාමර උෂ්ණත්වයේ ඇති තාප ශක්තිය ප්රමාණවත් නොවේ.
- ඝන අවස්ථාවේ දී ලන්ඩන් බල මගින් I2 අණු ක්රමවත් සැකැස්මක තබාගනියි.
- I2 අණුවල විශාල පෘෂ්ඨය ව.ඵ. විසින් යාබද අණු සමඟ ඇති කෙරෙන ලන්ඩන් බල නිසා අණුක දැලිස් ව්යුහයක් නිර්මාණය වේ.
- I2 අනු නිර්ධ්රැවීය බැවින් ධ්රැවීය ද්රාවක වලට වඩා අධ්රැවීය ද්රාවකවල ද්රාව්යතාවය වැඩිය.
ද්වීධ්රැව-ද්වීධැව අන්තර්ක්රියා
ස්ථිර ද්වීධ්රැවයක විද්යුත් ඍණතාවය වැඩි අග්රයට δ- ආරෝපණයක් ලැබෙන අතර විද්යුත් ඍණතාවය අඩු අග්රයට δ+ ආරෝපණයක් ලැබේ. මෙවැනි ස්ථිර ද්වීධ්රැව දෙකක ප්රතිවිරුද්ධ ආරෝපිත අග්ර අතර සාදාගන්නා ආකර්ෂණ බල ද්වීධ්රැව-ද්වීධැව අන්තර්ක්රියා වේ.
මේ ආකර්ෂණ ප්රබලතාවය 0.5 – 1.5KJmol-1 තරම් පරාසයක පැතිරී ඇත.
අණුවේ ධ්රැවීයතාවය වැඩිවත්ම ආකර්ෂණ බලයේ ප්රබලතාව වැඩිවේ.
මෙම අන්තර්ක්රියා හටගන්නේ ස්ථිර ද්වීධ්රැව දෙකක් අතර නිසා මෙම ආකර්ෂණ බලය සාමාන්යයෙන් අපකිරණ බල වලට වඩා ප්රබලතාවයෙන් වැඩිය.
හයිඩ්රජන් බන්ධන
මේවා ද්වීධ්රැව-ද්වීධැව අන්තර් ක්රියා ස්වරූපයක් වේ.
සමහර H බන්ධන අනෙකුත් ද්වීධ්රැව-ද්වීධැව අන්තර්ක්රියා වලට වඩා ප්රබල වේ.
බොහෝ විට H බන්ධනවල ශක්තිය 4-40KJmol-1 වූ පරාසයක පැතිරී ඇත.
F,N,O වැනි එකසර e යුග්ම 1ක් / කීපයක් ඇති පරමාණුවක් (X) H සමග බන්ධන සාදාගෙන ඇති විටෙක , H δ+ වන අතර X, δ- වේ. මෙහිදී Hට ලැබෙන භාගික ධන ආරෝපණය (δ+) අනෙකුත් පරමාණු සමඟ H බැඳී ඇති අවස්ථාවන්ට සාපේක්ෂව විශාලය.
හේතුව:- H හා X අතර විද්යුත් ඍණතා වෙනස සාපේක්ෂව ඉහල වීම.
තවද , H පරමාණුව සාපේක්ෂව කුඩා නිසා ඒ ආශ්රිත δ+ක් ඇති විටදී පවතින ස්ථිති විද්යුත් ක්ෂේත්ර තීව්රතාවයද සාපේක්ෂව ඉහළය.
මෙවැනි δ+ ආරෝපිත H පරමාණුවකට , තවත් මෙවැනිම විද්යුත් ඍණතාවය ඉහළ එකසර e යුග්ම 1ක් / කීපයක් ඇති δ- ආරෝපිත පරමාණුවක් (Y) සමග බන්ධන සාදාගත හැක.

මෙසේ δ- ලෙස ආරෝපිත N ,O , F පරමාණුවක් H පරමාණුවක් සමග බැඳී තිබීම අත්යවශ්ය නොවන අතර එය වෙනත් පරමාණුවක් වුවද විය හැකිය.
මේ ආකාරයේ H බන්ධන , අනෙකුත් ද්වීධ්රැව-ද්වීධැව ආකර්ෂණ බලවලට වඩා ප්රබලය.
එයට හේතු නම් :-
- H හා X (F,O,N) අතර ඇති ඉහළ විද්යුත් ඍණතා වෙනස
- H පරමාණු සැහැල්ලු නිසා ආකර්ෂණය කිරීම අපහසුයි
- H පරමාණුවේ ඇති තනි e ය, බන්ධන සාදා ගැනීමට සහභාගී වූ පසු න්යෂ්ටියේ ආචරණ බලය ඉතාමත් අවම වීම.
සජාතීය අණු අතර H බන්ධන ඇති අවස්ථාවන්ට උදාහරණ :-
H2O , HF , NH3 , CH3OH , CH3NH2
H බන්ධන වල සාපේක්ෂ ප්රබලතාවය අන්තයෙ වන පරමාණුවේ විද්යුත් ඍණතාවය මත සුළු වශයෙන් අඩු වැඩි වන බව විශ්වාස කෙරේ.
ඒ අනුව; ඉහත H බන්ධනවලින් ;
NH3 < H2O < HF ලෙස ප්රබලතාවය වැඩි වේ.
එකිනෙකට වෙනස් අණු අතර පවා H බන්ධන ඇති වේ.
උදා :- ජලය හා ඇසිටෝන් මිශ්රණය
ඇසිටික් අම්ලයට එහි කාබොක්සිලික් කාණ්ඩයේ H පරමාණුව හා එම කාණ්ඩයට අයත් C = Oකාණ්ඩයේ O පරමාණුව සමග H බන්ධන තැනිය හැක.
මේ අනුව δ- ආරෝපිත විද්යුත්සෘණ පරමාණුව සෑමවිටම H වලට බැඳීතිබීම අත්යවශ්ය නොවේ.
- අන්තඃ – අණුක බන්ධන :- එකම අණුවේ H පරමාණුවක් හා විද්යුත් සෘණ පරමාණුවක් අතර ඇතිවන H බන්ධනයි.
- අන්තර් – අණුක බන්ධන :- අණු දෙකක් අතර ඇතිවන H බන්ධන.
ඇතැම් අවස්ථාවන්හිදී විද්යුත් සෘණ පරමාණුව ලෙස Cl පරමාණුව ඇතිවිටද H බන්ධන ඇතිවේ. නමුත් ප්රබලතාවය තරමක් අඩුය.
මෙය ඇතුළත් වන පරිදි FONCl ලෙසට තවත් නීතියක් ඇත.
H බන්ධන පවතින බවට සාක්ෂි
- 15 , 16 , 17 කාණ්ඩවල මුල් මූලද්රව්යයන්ගේ හයිඩ්රයිඩ වලට අසාමාන්ය ඉහළ ද්රවාංක , තාපාංක පැවතීම
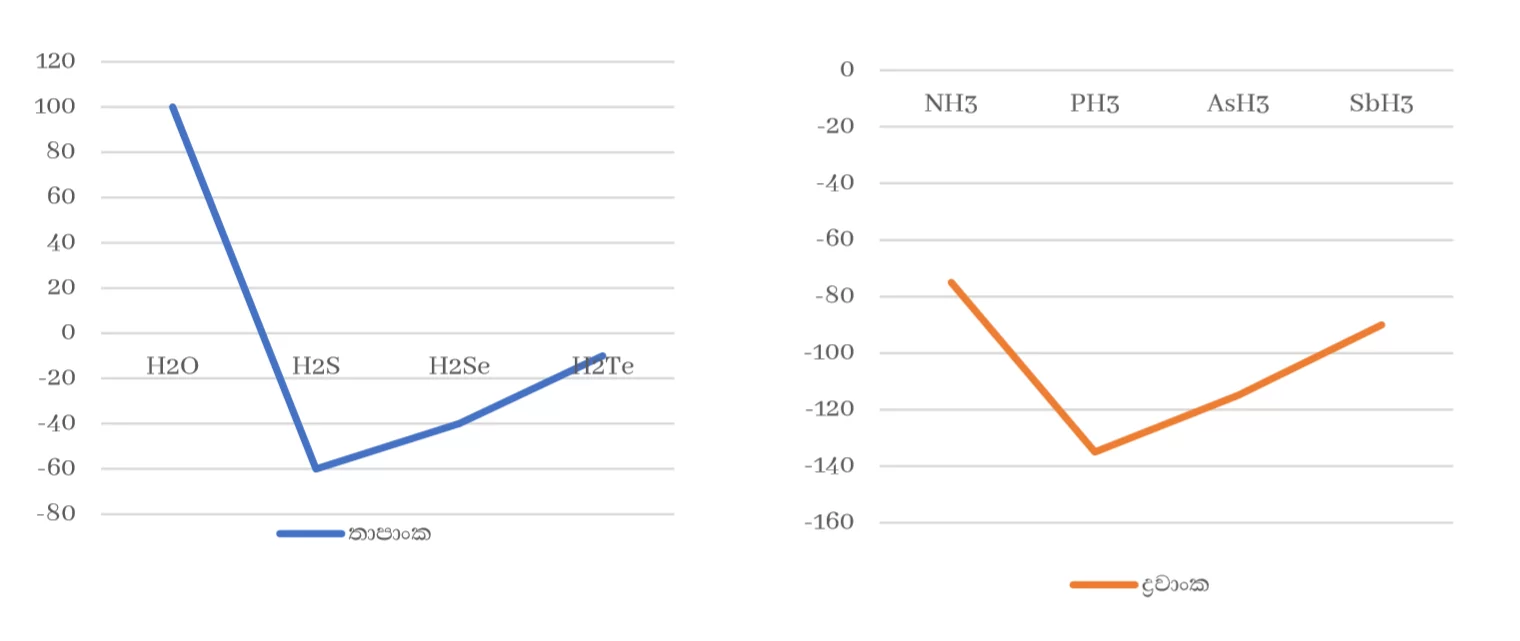
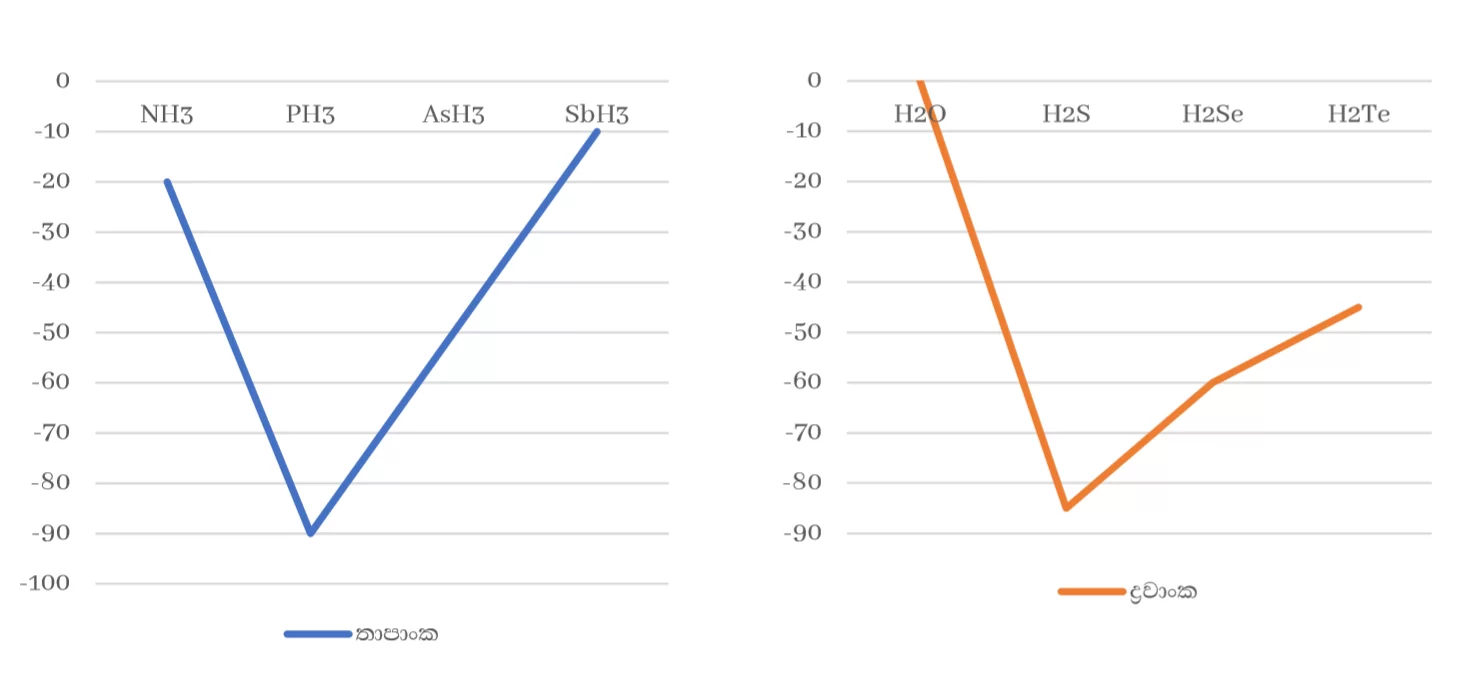
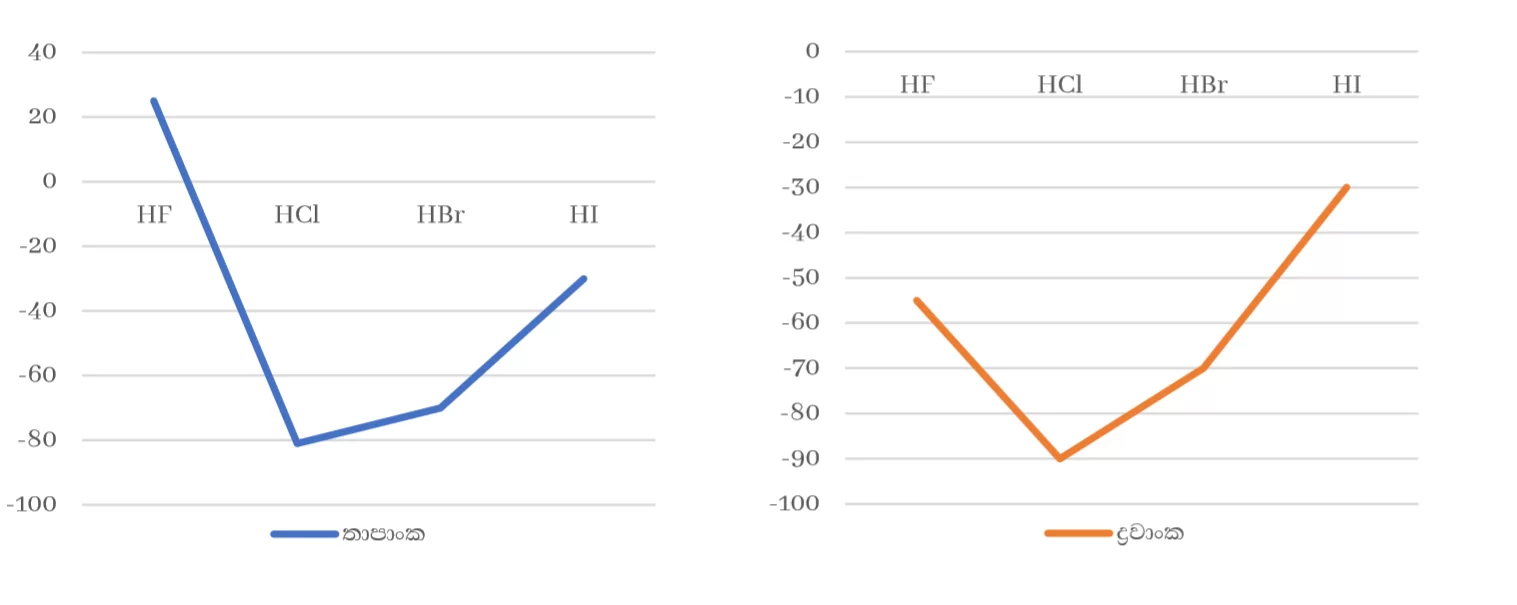
කාණ්ඩයක මූලද්රව්යයන්ගේ හයිඩ්රයිඩ වලට එකම ද්විතීක බන්ධන පවතින්නේ නම් කාණ්ඩයේ පහළට යාමේදී සාපේක්ෂ අණුක ස්කන්ධය හා ක්ෂේත්රඵලය වැඩි වීමට අනුරූපව ද්රවාංක , තාපාංක වැඩි විය යුතුය.
14 කාණ්ඩයේ මීට අනුරූප වුවත් 15 , 16 , 17 කාණ්ඩවල මුල් මූලද්රව්යයන්ගේ හයිඩ්රයිඩවලට අසාමාන්ය ඉහළ ද්රවාංක , තාපාංක පවතී. මෙයට හේතුව ඒවායේ ප්රබල H බන්ධන පැවතීමයි.
2. 15 ,16 , 17 කාණ්ඩවල මුල් මූලද්රව්යයන්ගේ හයිඩ්රයිඩවලට (NH3 , H2O , HF ) අසාමාන්ය ඉහළ ගුප්ත තාප හා තාප ධාරිතාවන් ඇත.
මෙයට හේතුව ඒවායේ ඇති ප්රබල H බන්ධනයි.
3. ජලයට වඩා H2S හි සාපේක්ෂ අණුක ස්කන්ධය විශාල වුවද H2O කාමර උෂ්ණත්වයේදී ද්රවයක් වන අතර H2S වායුවකි.
ඒ H2O ප්රබල H බන්ධන ඇති නිසාය.
4. HF , NH3 වල අසාමාන්ය ඉහළ ද්රාව්යතාවයක් ඇත.
H2O සමග H බන්ධන සෑදීමට පෙළඹීම මෙයට හේතුවයි.
සජීවී පද්ධතිවල පැවැත්ම කෙරේ H බන්ධනවල වැදගත්කම
- ජලයේ H බන්ධන තිබීම නිසා එය කාමර උෂ්ණත්වයේදී ද්රවයක් වේ. මේ නිසා සියලු සියලු ජීවීන්ට පහත ප්රයෝජන ලැබී ඇත.
- හොඳ ප්රතික්රියක් වීම.
- ජෛව රසායනික ප්රතික්රියා වලට මාධ්යයක් ලැබී ඇත.
- පරිවහන මාධ්යයක් ලැබී ඇත.
- ජීවත්වීමට පරිසරයක් ලැබී ඇත.
2. ජීවයේ රැහැන වන DNA ද්විත්ව දාමය බැඳී ඇත්තේ H බන්ධන වලිනි. මෙය ආවේණියේදී වර්ණදේහ සංඛ්යාව නියත කිරීම සඳහා වැදගත් වේ.
3. ජලයේ H බන්ධන පැවතීම නිසා එහි ගුප්ත තාපය ඉහළ අගයක් වේ. මෙය අචලතාපීන්ගේ දේහ උෂ්ණත්ව යාමනයට වැදගත් වේ. එනම්, අඩු ජල පරිමාවකින් වැඩි තාප ප්රමාණයක් පිටකළ හැකිවී ඇත.
4. ප්රෝටීනවල ද්වීතියික තෘතීයික ප්රෝටීන සෑදීමට H බන්ධන භාවිතා වී ඇත.
5. ද්රව ජලයේ බන්ධන පවතින්නේ දාමාකාරයට වන අතර අයිස් වලදී එය චක්රීය වේ. මේ නිසා ද්රව ජලය අයිස් වීමේදී පරිමා ප්රසාරණයක් සිදුවේ. මේ නිසා ජලයට වඩා අයිස්වල ඝනත්වය අඩුවේ. එමනිසා ජලය මත අයිස් තට්ටුව පාවේ. මෙය සෞම්ය කලාපීය රටවල ජලජ ජීවීන්ට වැදගත්වේ. ශීත සෘතුවේදී හටගන්නා අයිස් තට්ටුව ජලාශයේ මතුපිට ස්ථරයක් ලෙස පාවන අතර එය තාප පරිවාරකයක් ලෙස ක්රියාකර බාහිර පරිසර උෂ්ණත්ව විපර්යාසවලදී අභ්යන්තර ජලය ආරක්ෂා කරයි.
- ජලය වැනි අණුක ද්රව්යයන්ගේ හැසිරීම හා ගුණාංග ධ්රැවීයතා ආකෘතිය මගින් ගළපාගත හැක.
- අයිස්හි ඝනත්වය ජලයට වඩා 9%ක් පමණ අඩු නිසා අයිස් ජලය මත පාවේ.
- සිසිල් කිරීමේදී ජලයේ තාපජ ශක්තිය ඉවත්වන නිසා අනුව අණුවල චාලක ශක්තිය අඩු වීමෙන් 0°C හිදී ජලය අයිස් බවට පත්වේ. මෙහිදී ජල අණුවක් වටා ඇති විය හැකි H බන්ධන සංඛ්යාව වැඩිවේ. අණු ක්රමවත් රටාවකට ඇසිරේ.
- මෙහිදී එක් H2O අණුවක් , චතුස්තලීයව තවත් අණු 4කට බැඳී වළයාකාර ව්යුහයක් සාදා ඇත.
- අයිස්හි ස්ඵටික ව්යුහ ගණනාවක් ඇත. ඒවායේ ස්වභාවය රඳා පවතින්නේ අදාල සිසිලන තත්ත්වයන් මතයි.
සරල අණු කිහිපයක තාපාංක විචලනය ද්වීධ්රැව ඝූර්ණය හා අන්තර් අණුක බල ඇසුරෙන් :-
| අණුව | මවුලික ස්කන්ධය (gmol-1) | ද්වීධ්රැව ඝූර්ණය (D) | තාපාංකය (0C) | ප්රමුඛ අන්තර්ක්රියා වර්ගය |
| O2 | 32 | 0 | -183 | ලන්ඩන් බල |
| NO | 30 | 0.153 | -152 | ද්වීධ්රැව-ද්වීධැව |
| Br2 | 160 | 0 | 59 | ලන්ඩන් බල |
| ICl | 162.5 | 1.6 | 97 | ද්වීධ්රැව-ද්වීධැව |
- NO හා O2 මවුලික ස්කන්ධ ආසන්නව සමාන වුවත් NO හි තාපාංකය , O2 හි තාපාංකයට වඩා වැඩිය.
- එබැවින් , NO හි අන්තර් අණුක ආකර්ෂණ බල ප්රභලතාවය O2 ට වඩා වැඩිය.
- NO, එකිනෙකට වෙනස් මූලද්රව්ය වලින් සැදි අණුවකි. එම නිසා එය ධ්රැවීයයි. O2 අණුවේ ද්වීධ්රැව ඝූර්ණය ශුන්යයයි. දුර්වල ලන්ඩන් බල පමණක් පවතී.
- ද්රව අවස්ථාවේ අන්තර් අණුක බල බිඳීමට O2 වලට වඩා වැඩි තාප ශක්තියක් NO ට අවශ්යවෙයි.
- Br2 හා ICl සමඉලෙක්ට්රොනික වේ. Br2 නිර්ධ්රැවීයයි. ICl ධ්රැවීයයි. Br2 හි තාපාංකය ට වඩා ICl හි තාපාංකය වැඩියි. හේතුව ICl අන්තර් අණුක බල වඩාත් ප්රබල වීමයි. ප්රබල ද්වීධ්රැව-ද්වීධැව බල සහිත ඕනෑම ද්රව්යයකට විලයනයට හා නැටීමට සැලකිය යුතු තරම් ඉහළ ශක්තියක් අවශෝෂණය විය යුතුය.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



