සාන්ද්රණය දන්නා ද්රාවණයක් පිළියෙල කිරීම රසායනාගාරයෙන් ඇති ඝන ද්රව්ය හා ද්රාවණ භාවිතයෙන් සිදු කළ හැක.
ඝන ද්රව්ය භාවිතයෙන් ද්රාවණ පිළියෙල කිරීම
මෙහිදී පිළියෙල කලයුතු ද්රාවණයට අදාළ මවුල සංඛ්යාව මගින් ස්කන්ධය සොයා එය නිවැරදිව පිළියෙල කළ හැක.
I – නිර්ජල ඝන ද්රව්ය භාවිතයෙන්
පළමු ක්රමය –
- පිළියෙල කළ යුතු ද්රාවණයට අදාළ මවුල සංඛ්යාව සොයා ගැනීම.
- එම මවුල සංඛ්යාව ස්කන්ධයක් බවට පත් කෙරේ.
- එම ස්කන්ධය සිව්දඩු තුලාව ආධාරයෙන් ඔරලෝසු වීදුරුවකට නිවැරදිව කිරා ගනු ලැබේ.
- එම කිරාගත් ස්කන්ධය ආසූත ජලය හා පුනීලයක් භාවිතයෙන් පිරිසිදු පරිමාමිතික ප්ලාස්කුවකට සෝදා ගනු ලැබේ.
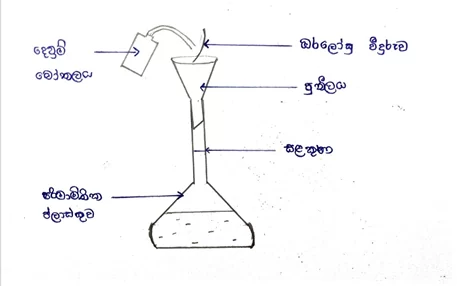
- ඔරලෝසු වීදුරුව හා පුනිලය තවදුරටත් ප්ලාස්කුව තුළට සෝදා හැර ප්ලාස්කුවේ පරිමාවෙන් තුනෙන් දෙකකට පමණ ආසූත ජලය එකතු කරයි.
- ප්ලාස්කුව වසා ඝන ද්රව්ය දිය වන තෙක් කිහිපවරක් සොළවනු ලැබේ.
- කාමර උෂ්ණත්වයට පැමිණීමට ඉඩ තැබීමෙන් පසු අදාල සළකුණ තෙක් ආසූත ජලය දමනු ලැබේ. මෙහිදී ද්රාවණ මට්ටම සලකුණට ආසන්න වන විට පිපෙට්ටුවක් භාවිතයෙන් ජලය දැමිය යුතුයි.
උදා-නිර්ජල NaOH භාවිතා කර 0.2 moldm-3 ද්රාවණ 500cm3 ක් පිළියෙල කරගන්නා ආකාරය පැහැදිලි කරන්න.
සෑදිය යුතු ද්රාවණය = 0.2 moldm-3 NaOH, 500cm3
ඒ සඳහා අවශ්ය මවුල = 0.2 moldm-3 x 500cm3 x 10-3
=0.1mol
එම නිසා අවශ්ය NaOH ස්කන්ධය = 0.1mol x 40 gmol-1
= 4.0 g
- NaOH වලින් 4g ක් සිව් දඬු තුලාව ආධාරයෙන් ඔරලෝසු වීදුරුවකට කියා ගනු ලැබේ.
- ආසූත ජලය හා පුනීලයක් ආධාරයෙන් පරිමාමිතික ප්ලාස්කුවකට මාරුකර ප්ලාස්කුවේ පරිමාවෙන් තුනෙන් දෙකකට පමණ ආසූත ජලය දමා කීප වරක් සොලවනු ලැබේ.
- කාමර උෂ්ණත්වයට පැමිණීමෙන් පසු 500cm-3 දක්වා ආසූත ජලය එකතු කෙරේ.
II – සජල ඝන ද්රව්ය භාවිතයෙන්
මෙහිදී ද සජල ඝන ද්රව්යයෙන් අවශ්ය ස්කන්ධය කිරාගෙන ඉහත ආකාරයටම පරීක්ෂණය සිදු කෙරේ.
උදා- රසායනාගාරයේ ඇති Na2CO3.10H20 සජල ලවණ භාවිතා කර 0.1 moldm-3 Na2CO3 ද්රාවණ 250cm3 සාදා ගන්නා ආකාරය පැහැදිලි කරන්න.
සෑදිය යුතු ද්රාවණය = 0.1 moldm-3 Na2CO3 , 250cm3
ඒ සඳහා අවශ්ය Na2CO3 මවුල = 0.1 moldm-3 x 250cm3 x 10-3
=0.025mol
එම නිසා අවශ්ය Na2CO3.10H20 ස්කන්ධය = 0.025mol x 286 gmol-1
= 7.15 g
- Na2CO3.10H20 වලින් 7.15g ක් සිව්දඩු තුලාවක් ආධාරයෙන් ඔරලෝසු වීදුරුවකට කිරා ගනු ලැබේ.
- ආසූත ජලය හා පුනීලයක් ආධාරයෙන් 250cm3 පරිමාමිතික ප්ලාස්කුවකට මාරු කර ප්ලාස්කුවේ පරිමාවෙන් තුනෙන් දෙකකට පමණ ජලය දමා කීප වරක් සොලවනු ලැබේ.
- කාමර උෂ්ණත්වයට ආ පසු 250cm3 දක්වා ආසූත ජලය එක් කෙරේ.
ද්රාවණ භාවිතයෙන් ද්රාවණ පිළියෙල කිරීම
මෙය ක්රම තුනකින් සිදු කරනු ලැබේ.
- වාණිජ ද්රාවණ භාවිතය
- සාන්ද්රණය දන්නා ද්රාවණ තනුක කිරීමෙන්
- සාන්ද්රණය දන්නා ද්රාවණ මිශ්ර කිරීමෙන්
- වාණිජ ද්රාවණ භාවිතයයෙන් ද්රාවණ පිළියෙල කිරීම
වාණිජ ද්රාවණය අම්ලයක් නම් පහත ක්රමය අනුගමනය කෙරේ.
- අවශ්ය මවුල සංඛ්යාව සොයා ගැනීම.
- එමගින් වාණිජ අම්ල ද්රාවණයෙන් ගත යුතු පරිමාව ගණනය කරනු ලැබේ.
- අම්ල පරිමාව මිනුම් සරාවකට නිවැරදිව මැන ගනු ලැබේ.
- පිරිසිදු බීකරයකට සැලකිය යුතු ආසුත ජල පරිමාවක් දමා එයට මැනගත් අම්ල ද්රාවණය ස්වල්පයක් බැගින් කලවම් කරමින් දමනු ලැබේ.
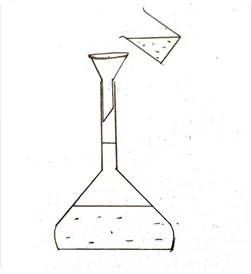
- බීකරය තුල ද්රාවණය කලවම් කර පුනීලයක් ආධාරයෙන් පරිමාමිතික ප්ලාස්කුවට මාරු කරනු ලැබේ
- බීකරය හා පුනීලය ආසූත ජලය මගින් තවදුරටත් ප්ලාස්කුව තුළට සෝදා හැර කාමර උෂ්ණත්වයට පැමිණීමට ඉඩ හරිනු ලැබේ.
- අදාල සළකුණ දක්වා අවශ්ය ජලය එකතු කෙරේ මෙහිදී සලකුණ ආසන්නයේදී පිපෙට්ටුවක් භාවිතා කරනු ලැබේ.
සැලකිය යුතුයි
- සාන්ද්ර අම්ල ජලය සමග මිශ්ර කිරීමේදී විශාල තාප ප්රමාණයක් පිට වේ. එම නිසා ආරම්භයේ දී බීකරයට ගන්නා ජල පරිමාව හැකි තරම් විශාල විය යුතුයි.
- මිනුම් සරාවේ ඇති අම්ලය වරකට ස්වල්පය බැගින් එකතු කළ යුතුයි. (විශාල තාප ප්රමාණයක් මුක්ත වන බැවින්)
- අම්ලයට ජලය එකතු කිරීම නොකළ යුතුයි එවිට ස්පෝටනය වීම වළක්වා ගත හැක.
- මිනුම් සරාව බීකරය ට සෝදා හැරීම නොකළ යුතුයි.
- මිනුම් සරාවේ අම්ල පරිමාව හා ද්රාවණ පරිමා වල එකතුව සෑදිය යුතු ද්රාවණ පරිමාවට වඩා වැඩි නොවිය යුතුය.
උදා – රසායනාගාරයේ ඇති 1.84gcm3 ඝනත්වය හා ප්රතිශත සංශුද්ධතාවය 98% වන වාණිජ H2SO4 ද්රාවණයකින් 0.1 moldm-3 ද්රාවණය 500cm3 පිළියෙළ කරන ආකාරය පැහැදිලි කරන්න.
සැදිය යුතු ද්රාවණය = 0.1 moldm-3 H2SO4 , 500cm3
ඒ සදහා අවශ්ය මවුල = 0.1 moldm-3 x 500cm3 x 10-3
= 5 x 10-2 mol
මෙම මවුල ප්රමාණය වාණිජ H2SO4 ද්රාවණයෙන් ගත යුතුයි
වාණිජ ද්රාවණයේ 1cm3 ක ස්කන්ධය = 1.84g
වාණිජ ද්රාවණයේ 1cm3 ක H2SO4 ස්කන්ධය = 1.84g x 98/100
වාණිජ ද්රාවණයේ මවුල ගණන = 1.84g x 98/100 x 1/98gmol-1
= 1.84x 10-3 mol
එමනිසා වාණිජ ද්රාවණයේ 5 x 10-2 mol ගැනීමට
අවශ්ය පරිමාව = 1cm3 x 5 x 10-2 mol/1.84x 10-3 mol
= 2.72 cm3
- බීකරයකට ආසුත ජලය 300cm3 පමණ ගෙන ඉහත අම්ල ද්රාවණ පරිමාව මිනුම් සරාවකින් නිවැරදිව මැන බින්දුව බැගින් කලවම් කර බිහිකරයට දැමිය යුතුයි.
- පුනීලයක් මගින් බීකරයේ ඇති ද්රාවණය 500cm3 පරිමාමිතික ප්ලාස්කුවකට දමා බීකරය හා පුනීලය තවදුරටත් ප්ලාස්කුව තුළට සෝදා ගනු ලැබේ.
- කාමර උෂ්ණත්වයට ආ පසු 500cm3 සලකුණ දක්වා ආසූත ජලය එකතු කරනු ලැබේ.
- සාන්ද්රණය දන්නා ද්රාවණය තනුක කිරීම මගින්
උදා – රසායනාගාරයේ ඇති 6moldm-3 ද්රාවණය භාවිතයෙන් HCl ද්රාවණ 250cm3 පිළියෙළ කරගත යුතුව ඇත. අදාළ ක්රමය කෙටියෙන් පැහැදිලි කරන්න.
නව සාන්ද්රණය = ආරම්භක සාන්ද්රණය x ආරම්භක පරිමාව/අවසන් පරිමාව
මෙහිදී තනුක කිරීමක් සිදු නොකරන බැවින් 6moldm-3 HCl ද්රාවණයෙන් අවශ්ය පරිමාව පහත සමීකරණය මගින් සෙවිය හැක.( සෙවිය යුතු පරිමාව V යැයි ගනිමු)
1.0 moldm-3 = 6 moldm-3 x V/250cm3
V = 250cm3 /6
= 41.67 cm3
මෙම අම්ල පරිමාව මිනුම් සරාව කින් නිවැරදිව මැන පුනීලයක් ආධාරයෙන් 250cm3 පරිමාමිතික ප්ලාස්කුවකට දමනු ලැබේ. පුනීලය ආසූත ජලයෙන් තවදුරටත් ප්ලාස්කුව තුළට සෝදා හැර 250cm3 සලකුණ දක්වා ආසූත ජලය එකතු කෙරේ.
- සාන්ද්රණය දන්නා ද්රාවණ දෙකක් මිශ්ර කිරීම මගින් ද්රාවණ පිළියෙල කිරීම
මෙහිදී ද්රාවණ දෙකක් මිශ්ර කරන බැවින් පහත සමීකරණය භාවිතා කළ හැක.
C1V1 + C2V2 = CV
උදා – රසායනාගාරයේ 3 moldm-3 HCl ද්රාවණයක් හා 0.5 moldm-3 HCl ද්රාවණයක් ඇත. මෙම ද්රාවණ දෙකක් භාවිතා කර 1 moldm-3 HCl ද්රාවණ 250 cm3 ක් සාදාගන්නා ආකාරය පැහැදිලි කරන්න.
C1V1 + C2V2 = CV
(3M x V1) + [0.5M x (250-V1)] = 1M x 250
3V1 + 125 – 0.5V1 = 250
V1 = 50 cm3
V2 = 200 cm3
ඉහත ද්රාවණ පරිමා දෙකක මිනුම් සරාවක් මගින් නිවැරදිව මැන මිශ්ර කිරීමෙන් අදාල ද්රාවණය ලැබේ.
ප්රතිශත සංයුතිය, ආනුභවික සූත්රය හා අණුක සූත්රය
ප්රතිශත සංයුතිය
කිසියම් සංයෝගයක ඇති එක් එක් මුලද්රව්ය ස්කන්ධයේ ප්රතිශතයක් ලෙස දැක්වීමෙන් ප්රතිශත සංයුතිය ලැබේ.
ප්රතිශත සංයුතිය සෙවීම ක්රම දෙකකින් සිදු කළ හැක.
- සංයෝගයේ සූත්රය භාවිතයෙන්
- සංයෝගයේ දහන දත්ත භාවිතයෙන්
- සූත්රය භාවිතයෙන් ප්රතිශත සංයුතිය සෙවීම
සංයෝගේ කිසියම් මූලද්රව්යයක සාපේක්ෂ පරමාණුක ස්කන්ධය එහි සූත්රයේ ඇති පරමාණු සංඛ්යාවෙන් ගුණ කර සංයෝගය අණුක ස්කන්ධයෙන් බෙදීමෙන් මූලද්රව්යයේ ප්රතිශත සංයුතිය සෙවිය හැක.
ස්කන්ධ ප්රතිශතය = සාපේක්ෂ පරමාණුක ස්කන්ධය x පරමාණු ගණන x100% /සාපේක්ෂ අණුක ස්කන්ධය
උදා – C4H6O සූත්රයේ ඇති කාබනික සංයෝගයෙ එක් එක් මූලද්රව්යයේ ස්කන්ධ ප්රතිශතය සොයන්න.
C4H6O වල සාපේක්ෂ අණුක ස්කන්ධය = 12×4 + 1×6 + 16
= 70
C ප්රතිශත = 12×4/70 x100% H ප්රතිශත = 1×6/70 x100%
= 68.57% = 8.57%
O ප්රතිශත = 16/70 x100%
= 22.86%
- දහන දත්ත භාවිතයෙන් ප්රතිශත සංයුතිය සෙවීම
කාබන් හා හයිඩ්රජන් පමණක් අඩංගු ඕනෑම සංයෝගය එනම් ඕනෑම හයිඩ්රොකාබනයක් පූර්ණ දහනයේදී ලැබෙන එකම ඵල කාබන්ඩයොක්සයිඩ් හා ජලය වේ. දහන ප්රතික්රියාව ට අදාළ පොදු සමීකරණය පහත දැක්වේ.
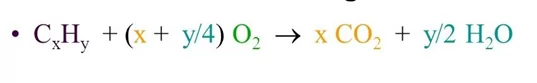
කාබන් හයිඩ්රජන් හා ඔක්සිජන් පමණක් අඩංගු සංයෝගයක් ද සම්පූර්ණයෙන්ම දානය කළ විට එකම ඵල ලෙස කාබන්ඩයොක්සයිඩ් හා ජලය පමණක් ලබා දේ මෙයට අදාළ පොදු සමීකරණය පහත ලෙස ලිවිය හැක.
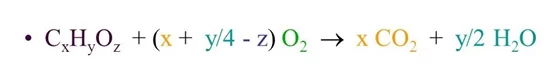
ආනුභවික සූත්රය
සංයෝගයක ප්රතිශත සංයුතියට අනුකූල වන ලෙස එක් එක් මූලද්රව්යයේ පරමාණු සංඛ්යා අතර සරලම පුර්ණ සංඛ්යාමය අනුපාතය දැක්වෙන සූත්රය ආනුභවික සූත්රය ලෙස හැදින්වේ. එනම් සංයෝගයේ ඇති අණුවක ඇති එක් එක් මූලද්රව්ය සරල පූර්ණ සංඛ්යාමය පරමාණු අනුපාතය දැක්වෙන සූත්රයයි.
උදා – glucose හි සූත්රය C6H12O6 මෙහි පරමාණු සංඛ්යාව අතර සරලම පුර්ණ සංඛ්යාමය අනුපාතය දැක්වෙන සූත්රය CH2O වේ. එනම් ආනුභවික සූත්රය වේ.
ආනුභවික සූත්රය නිර්ණය කිරීම
- සංයෝගයේ ඇති එක් එක් මූල ද්රව්යයේ ස්කන්ධ ප්රතිශතය හෝ ස්කන්ධ ඒවායේ සාපේක්ෂ පරමාණුක ස්කන්ධ වලින් බෙදනු ලැබේ.
- ඉහත පළමු පියවරෙහි ලැබෙන අගයන් එහි කුඩාම අගයෙන් බෙදනු ලැබේ.
- ඉහත දෙවන පියවරෙහි ලැබෙන අගයන් සරලම පුර්ණ සංඛ්යාමය අනුපාතයක් ලෙස ලියනු ලැබේ. එමගින් ආනුභවික සූත්රය ලබාගත හැක. මෙහිදී 0.1, 0.2, 0.8, 0.9 දශම ස්ථාන ලැබේනම් ආසන්න පූර්ණ සංඛ්යාවට වටයනු ලැබේ.
- නමුත් 0.3 සිට 0.7 දක්වා දශම ස්ථාන ලැබේනම් ආසන්න පූර්ණ සංඛ්යාව එළඹෙන තෙක් පිළිවෙලින් දෙකෙන් තුනෙන් …. ලෙස ගුණ කරයි.
උදා – කාබනික සංයෝගයක ස්කන්ධය අනුව C 10.06% ක් H 0.84% ක් Cl 89.1% ක් අඩංගු වේ. ංයෝගයෙ ආනුභවික සූත්රය නිර්ණය කරන්න. ( C = 12 , H = 1 , Cl = 35.5 )
| C | H | O |
| 10.06/12 | 0.84/1 | 89.1/35.5 |
| 0.838 | 0.84 | 2.50 |
| 0.838/0.838 | 0.84/0.838 | 2.50/0.838 |
| 1 | 1.002=1 | 2.99=3 |
එමනිසා ආනුභවික සූත්රය = CHCl3
අණුක සූත්රය
කිසියම් සංයෝගයක අණුවක් තුළ ඇති මුලද්රව්යයේ පරමාණු සංඛ්යා දැක්වෙන සූත්රය එහි අණුක සූත්රය ලෙස හැදින්වේ.
සංයෝගයෙන් මවුල එකක් තුළ එක් එක් මූල ද්රව්යයේ මවුල සංඛ්යා දැක්වෙන සූත්රය ලෙස ද අණුක සූත්රය හැදින්විය හැක.
අණුක සූත්රය එහි ආනුභවික සූත්රය පුර්ණ සංඛ්යාමය ගුණාකාරයක් වේ.
අණුක සූත්රය = (අනුභවික සූත්රය)n
මෙහි n අගය පුර්ණ සංඛ්යාමය ගුණාකාරයක් වේ.
n සෙවීම
ඉහත සමීකරණයේ අණුක සූත්රය වෙනුවට සාපේක්ෂ අණුක ස්කන්ධය ආනුභවික සූත්රය වෙනුවට ආනුභවික සූත්ර ස්කන්ධයක් ආදේශ කිරීමෙන් n සෙවිය හැක.
| n= | සාපේක්ෂ අණුක ස්කන්ධය/ |
| ආනුභවික සූත්ර ස්කන්ධය |
උදා – එක්තරා කාබනික සංයෝගයක ආනුභවික සූත්රය CH2O වේ. මෙහි සාපේක්ෂ අණුක ස්කන්ධය 90 නම් අණුක සූත්රය සොයන්න. ( C-12 , H-1 , O-16 )
| අණුක සූත්රය = (අනුභවික සූත්රය)n = (CH2O)3 = C3H6O3 |
| n = | සාපේක්ෂ අණුක ස්කන්ධය |
| ආනුභවික සූත්ර ස්කන්ධය | |
| = | 90/30 |
| = | 3 |
රසායනික සමීකරණ තුලිත කිරීම
රසායනික ප්රතික්රියාවකට අදාල සමීකරණය තුලිත කිරීම ක්රම කිහිපයකින් සිදු කළ හැක.
- Redox ක්රමය ( ඔක්සිහරණ ඔක්සිකරණ ක්රමය)
- සෝදිසි ක්රමය
- වීජ ගණිතමය ක්රමය
- Redox ක්රමය
ඔක්සිකරණ අංකය වෙනස් වන රසායනික ප්රතික්රියාවල දී එම සමීකරණ තුලිත කිරීම සදහා මෙම ක්රමය භාවිතා කෙරේ එම නිසා ඔක්සිකරණ අංක අවශ්ය වේ.
ඔක්සිකරණ අංක
බන්ධන සෑදීමේ දී කිසියම් පරමාණුවක් මගීන් සම්පූර්ණයෙන්ම හෝ අර්ධ ලෙස ලබාගන්නා හෝ පිට කරන ඉලෙක්ට්රෝන සංඛ්යාව නිසා එය මත ඇතිවන ආරෝපණය එහි ඔක්සිකරණ අංකය ලෙස හැදින්වේ.
මෙහිදී ඉලෙක්ට්රෝන පිටකළ විට ඔක්සිකරණ ධන අගයක් ගන්නා අතර ඉලෙක්ට්රෝන ලබා ගැනීමේදී ඍණ අගයක් ගනී.
එම නිසා IUPAC ක්රමයට අනුව ඔක්සිකරණ අංකය එහි සලකුණ (+/-) සමග රෝම ඉලක්කමෙන් ලියනු ලැබේ. නමුත් සාමාන්ය ක්රමයේදී සලකුණ සමග සාමාන්ය ඉලක්කමෙන් ලියයි.
ඔක්සිකරණ අංකය සෙවීම ( සහසංයුජ සංයෝග සඳහා)
සහසංයුජ සංයෝග වලදී ඔක්සිකරණ අංකය සෙවීම ක්රම දෙකකින් සිදු කළ හැක.
- ව්යුහ සූත්රය මගින්
- වීජ ගණිතමය ක්රමය මගින්
- ව්යුහ සූත්ර මගින් ඔක්සිකරණ අංකය සෙවීම
සහසංයුජ සංයෝග වලදී විද්යුත් ඍණතාව වැඩි පරමාණුව මගින් බන්ධන ඉලෙක්ට්රෝන යුගලය වැඩිපුර ආකර්ෂණය කිරීම නිසා එම පරමාණු දෙක මත ඇතිවන ආරෝපණය ඒවායේ ඔක්සිකරණ අංක වේ. එම නිසා මෙම ඔක්සිකරණ අංක සෙවීම විද්යුත් ඍණතාවෙ පහත අනුපිළිවෙල වැදගත් වේ.
F > O > Cl > N > Br > I > S > C > Se > P > H
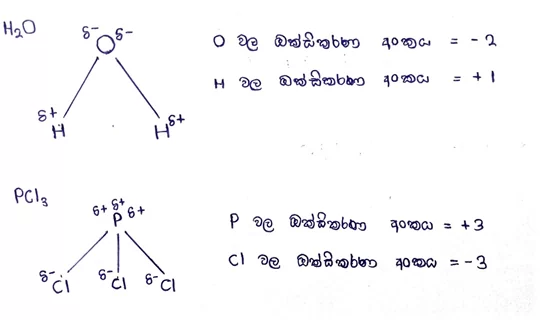
උදා –
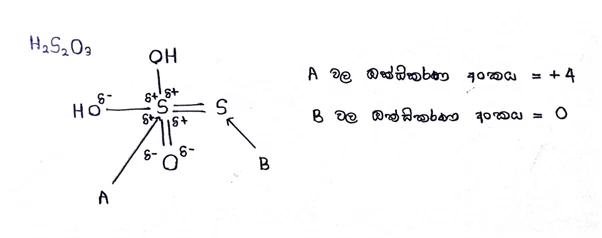
එකම වර්ගයේ පරමාණු වල විද්යුත් ඍණතා එක සමාන බැවින් ධ්රැවීකරණය සිදු නොවේ.
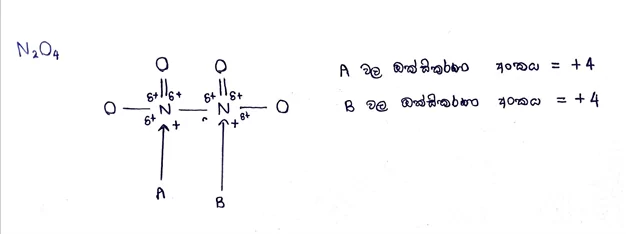
දායක බන්ධනයක් ඇති විට එම බන්ධනයේ ධ්රැවීකරණය නිසා ඇතිවන ආරෝපණයක් බන්ධනය සෑදීමේදී ඇතිවන ආරෝපණය යන දෙකම සැලකිය යුතුයි.
- වීජ ගණිතමය ක්රමය මගින් ඔක්සිකරණ අංක සෙවීම
- පළමු කාණ්ඩයේ ලෝහවල ක්ෂාර ලෝහවල ඔක්සිකරණ අංක සැමවිටම +1 වේ.
- දෙවන කාණ්ඩයේ ලෝහවල ක්ෂාරීය පාංශු ලෝහවල ඔක්සිකරණ අංකය සැමවිටම+2 වේ.
- මූලද්රව්යමය අවස්ථාවේදී ඔක්සිකරණ අංකය සැමවිටම 0 වේ.
උදා – Na , Mg , O2 , N2 , S8 , P4
- හයිඩ්රජන් වල ඔක්සිකරණ අංකය අලෝහයකට සම්බන්ධ වී ඇති විට +1 වන අතර ලෝහයකට සම්බන්ධ වී ඇති විට -1 වේ.
- ඔක්සිජන් වල බහුලව ඔක්සිකරණ අංකය -2 වේ. ( සංයෝජිත අවස්ථාවේ) මීට අමතරව -1, -½, +1, +2 ඔක්සිකරණ අංක ද පෙන්වයි.
- සංයෝජිත අවස්ථාවේදී ෆ්ලෝරීන් වල එකම ඔක්සිකරණ අංකය -1 වේ. ෆ්ලෝරීන් වලට වඩා විද්යුත් සෘණ මුලද්රව්යයක් නැති බැවින් එය ධන ඔක්සිකරණ අවස්ථා පෙන්විය නොහැක.
- ඒක පරමාණුක අයනයක දී එහි ඔක්සිකරණ අංකය අයනය හි ආරෝපණයට සමාන වේ.
- අණුවක දී එහි ඇති පරමාණු වල ඔක්සිකරණ අංක වල වීජ ගණිතමය ඓක්යය 0 වේ.
- බහුපරමාණුක අයනයක දී එහි ඇති පරමාණු වල ඔක්සිකරණ අංකවල වීජ ගණිතමය ඓක්ය එහි ආරෝපණයට සමාන වේ.
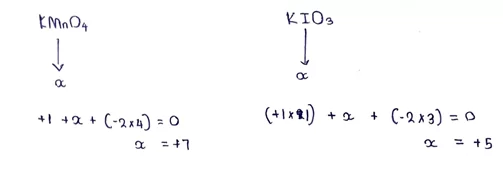
අයන වල දී ඔක්සිකරණ අංකයවල වීජ ගණිතමය ඓක්ය අයනයේ ආරෝපණය ට සමාන වේ.

ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



