ඉලෙක්ට්රෝන පිරීමේ රටාවට අදාල මූලධර්ම සහ නීති
1.පවුලි බහිෂ්කාර මූලධර්මය
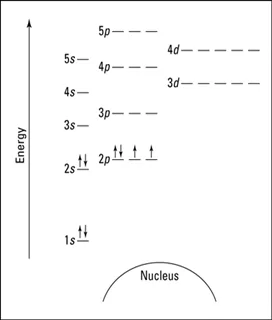
මින් පැහැදිලි කරනුයේ යම් කාක්ෂිකයක උපරිම ඉලෙක්ට්රෝන 2කට වඩා පැවතිය නොහැකි බවයි. එමෙන්ම ඉලෙක්ට්රෝන 2 ක් පවතින කාක්ෂිකවල ඒවා ප්රතිවිරුද්ධ දිශාවලට භ්රමණය වෙමින් පවතී. ශක්තිය වැඩිවන පිලිවලට කාක්ෂිකයට ඉලෙක්ට්රෝන පිරීම සිදු වේ.
පරමාණුවක යම් ඉලෙක්ට්රෝනයක් සදහා වන ක්වොන්ටම් අංක කුලකය එයටම අන්යය වන බවත් ඉලෙක්ට්රෝන දෙකකට එකම ක්වොන්ටම් අංකය පැවතිය නොහැකි බවත් තවදුරටත් මෙයින් පැහැදිලි කෙරේ.
2.හූන්ඩ්ස් නියමය
උපශක්ති මට්ටමක පිහිටි කාක්ෂිකවලට ඉලෙක්ට්රෝන පිරීමේදී පළමුව සෑම කාක්ෂිකයකටම ඉලෙක්ට්රෝන එක බැගින් පිරී දෙවනුව යුගලනය වන බව මෙයින් කියැවේ.
කාක්ෂිකයක පවතින ඉලෙක්ට්රෝන අර්ධ ඊ හිසකින් සමන්විත ඊතලයක් මගින් නිරූපණය කරනු ලැබේ.කාක්ෂිකය තුල ඉලෙක්ට්රෝන 2ම පවතියි නම් ඒවා යුගලනය වූ ඉලෙක්ට්රෝන ලෙසත් 1 බැගින් පවතියි නම් ඒවා වියුග්ම ඉලෙක්ට්රෝන ලෙසත් සැලකේ.

s කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේ රටා,
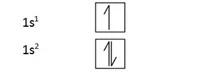
p කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේ රටා,
p1 < p2 < p3 < p4 < p5 < p6
ස්ථායිතාව වැඩි වේ
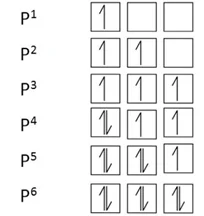
- np3 අර්ධ පිරීම වඩා np6 පූර්ණ පිරීම ස්තාථායිතාවයෙන් වැඩිය.
- np3 අර්ධ පිරීමට වඩා np5 පිරීම ස්ථායිතාවයෙන් අඩුය.
d කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේ රටා,
- d කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේදී nd5 nd10 විශේෂ ස්ථායිතාවයක් පෙන්වයි.
3.අවුෆ්බාවූ මූලධර්මය ( ගොඩනැංවීමේ මූලධර්මය )
- එක් එක් ප්රධාන ශක්ති මට්ටම් තුල උපශක්ති මට්ටම්වල අන්තර්ගත වූ කාක්ෂික වලට ඉලෙක්ට්රෝන පිරෙනුයේ ශක්තිය ක්රමානූකූල ලෙස වැඩිවන අනුපිළිවෙලටය. එහිදී උපශක්ති මට්ටම්වල ශක්තිය වැඩිවන අනුපිළිවෙල පහත පරිදිය.
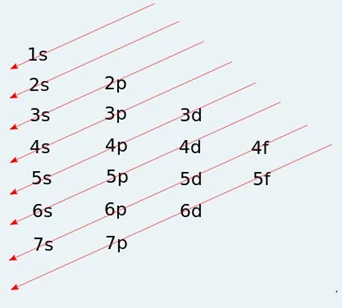
- ඒ අනුව ශක්තිය වැඩිවන අනුපිළිවෙලට උපශක්ති මට්ටම් වලට ඉලෙක්ට්රෝන පිරීමේ අනුපිළිවෙල පහත පරිදි වේ.
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s <5f <6d <7p
ඉලෙක්ට්රෝන වින්යාසය
ඉලෙක්ට්රෝන වින්යාසය යනුවෙන් අදහස් වන්නේ පරමාණුවක හෝ අයනයක ඉලෙක්ට්රෝන න්යෂ්ටිය වටා ව්යාප්ත වී ඇති අකාරයයි. මෙහිදී ප්රධාන ශක්ති මට්ටම් ,උපශක්ති මට්ටම් හා කාක්ෂික යන ව්යාප්ති ඒකක තුන තුළ ඉලෙක්ට්රෝන ව්යාප්තිය සලකා බැලේ.මූලද්රව්ය වල ඉලෙක්ට්රෝන වින්යාස ලියා දැක්වීම පහත ආකාර වේ.
|
# |
Element |
Electron configuration |
|
1 |
Hydrogen |
1s1 |
|
2 |
Helium |
1s2 |
|
3 |
Lithium |
1s2 2s1 |
|
4 |
Beryllium |
1s2 2s2 |
|
5 |
Boron |
1s2 2s2 2p1 |
|
6 |
Carbon |
1s2 2s2 2p2 |
|
7 |
Nitrogen |
1s2 2s2 2p3 |
|
8 |
Oxygen |
1s2 2s2 2p4 |
|
9 |
Fluorine |
1s2 2s2 2p5 |
|
10 |
Neon |
1s2 2s2 2p6 |
|
11 |
Sodium |
1s2 2s2 2p6 3s1 |
|
12 |
Magnesium |
1s2 2s2 2p6 3s2 |
|
13 |
Aluminum |
1s2 2s2 2p6 3s2 3p1 |
|
14 |
Silicon |
1s2 2s2 2p6 3s2 3p2 |
|
15 |
Phosphorous |
1s2 2s2 2p6 3s2 3p3 |
|
16 |
Sulfur |
1s2 2s2 2p6 3s2 3p4 |
|
17 |
Chlorine |
1s2 2s2 2p6 3s2 3p5 |
|
18 |
Argon |
1s2 2s2 2p6 3s2 3p6 |
|
19 |
Potassium |
1s2 2s2 2p6 3s2 3p6 4s1 |
|
20 |
Calcium |
1s2 2s2 2p6 3s2 3p6 4s2 |
|
21 |
Scandium |
1s2 2s2 2p6 3s2 3p6 4s2 3d1 |
|
22 |
Titanium |
1s2 2s2 2p6 3s2 3p6 4s2 3d2 |
|
23 |
Vanadium |
1s2 2s2 2p6 3s2 3p6 4s2 3d3 |
|
24 |
Chromium |
1s2 2s2 2p6 3s2 3p6 4s2 3d4 |
- 3d4 පිරීමට වඩා 3d5 පිරීම ස්ථායීතාවයෙන් වැඩි බැවින් 4s වලින් වලින් ඉලෙක්ට්රෝනයක් 3d වෙතට සංක්රමණය වෙමින් 4s13d5 ස්ථායි වින්යාසය ලබා ගනියි.


- මෙසේ වීමට නම් අදාල ශක්ති මට්ටම් එකිනෙක ආසන්නයේ තිබිය යුතු අතර ඉලෙක්ට්රෝන සංක්රමණයට අදාල ශක්තිය අඩු අගයක් විය යුතුය.පහත රූපයේ දැක්වෙන්නේ උපශක්ති මට්ටම් වල විභව ශක්ති වැඩි වීමේ පිලිවලයි.
- පරමාණුක ක්රමාංකය 25 සිට 40 දක්වා මූලද්රව්ය වල ඉලෙක්ට්රෝන වින්යාස පහත පරිදි වේ
|
25 |
Manganese |
1s2 2s2 2p6 3s2 3p6 4s2 3d5 |
|
26 |
Iron |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 |
|
27 |
Cobalt |
1s2 2s2 2p6 3s2 3p6 4s2 3d7 |
|
28 |
Nickel |
1s2 2s2 2p6 3s2 3p6 4s2 3d8 |
|
29 |
Copper |
1s2 2s2 2p6 3s2 3p6 4s1 3d10 |
|
30 |
Zinc |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 |
|
31 |
Gallium |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p1 |
|
32 |
Germanium |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p2 |
|
33 |
Arsenic |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p3 |
|
34 |
Selenium |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p4 |
|
35 |
Bromine |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p5 |
|
36 |
Krypton |
1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p6 |
|
37 |
Rubidium |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 |
|
38 |
Strontium |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 |
|
39 |
Yttrium |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d1 |
|
40 |
Zirconium |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d2 |
- පරමාණුක ක්රමාංකය 41ට වැඩි ඇතැම් මූලද්රව්ය අවුෆ්බාවූ නියමය නොසලකා හරිමින් ස්ථායි වින්යාස ද නොසලකා හරිමින් සංකීර්ණ ආකාරයට පිරේ.
උදා : 41, 43, 44, 45, 46
උපශක්ති මට්ටම්වල ඉලෙක්ට්රෝන සංකේත කිරීම
3d6
3 → ප්රධාන ශක්ති මට්ටම
d → උපශක්ති මට්ටම
6 → එහි වූ ඉලෙක්ට්රෝන ගණන
- 3 වන ප්රධාන ශක්ති මට්ටමේ d උප මට්ටමේ ඉලෙක්ට්රෝන 6ක් ඇති බව මින් අදහස් කෙරේ.
උදා : යකඩ වල පරමාණුක ක්රමාංකය 26කි. එහි ඉලෙක්ට්රෝන වින්යාසය ලියා සංයූජතා කවචයේ ඉලෙක්ට්රෝන නිරූපණය කර වියුග්ම ඉලෙක්ට්රෝන ගණන සොයන්න.
- ඉලෙක්ට්රෝන වින්යාසය = 1s2 2s22p6 3s23p63d6 4s2
- පරමාණුක ක්රමාංකය = 26
අවසාන ශක්ති මට්ටම = 4s2
- වියුග්ම ඉලෙක්ට්රෝන = 4
කැටායන වල ඉලෙක්ට්රෝන වින්යාස ලිවීම
- පරමාණුවක අවසාන ශක්ති මට්ටමේ වූ උපශක්ති මට්ටමෙන් ඉලෙක්ට්රෝන ඉවත් කර අනුරූප කැටායන සාදයි.
උදා :Fe – 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe2+ – 1s2 2s2 2p6 3s2 3p6 3d5
Fe3+ – 1s2 2s2 2p6 3s2 3p6 3d5
Cr – 1s2 2s2 2p6 3s2 3p6 3d6 4s1
Cr2+ – 1s2 2s2 2p6 3s2 3p6 3d4
Cr3+ – 1s2 2s2 2p6 3s2 3p6 3d3
Co – 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Co2+ – 1s2 2s2 2p6 3s2 3p6 3d7
Co3+ – 1s2 2s2 2p6 3s2 3p6 3d6
Cu – 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Cu+ – 1s2 2s2 2p6 3s2 3p6 3d10
Cu2+ – 1s2 2s2 2p6 3s2 3p6 3d9
- මින් ජලීය ද්රාවණ වලදී වඩා ස්ථායි වනුයේ Cu2+ වේ. ජලීය ද්රාවණයේදී ස්ථායීතාව කෙරෙහි සජලන එන්තැල්පිය බලපායි. අරය අඩු වී ආරෝපණය වැඩි වන විට මෙය වැඩි වේ.
- ඉලෙක්ට්රෝන පිරීමේ ස්ථායිතාව මත අයන වල ස්ථායිතාව කතා කරනුයේ වායුමය අවස්ථාවලදී පමණි.
ඇනායන වල ඉලෙක්ට්රෝන වින්යාසය ලිවීම
- පරමාණුවක අවසාන උපශක්ති මට්ටම පිරෙන තෙක් ඉලෙක්ට්රෝන ලබාගෙන ඍණ අයන සාදයි. මේ අනුව H , He වින්යාසය ලබා ගන්නා අතර අනෙක් සෑම අයනයක්ම ns2 np6 නිෂ්ක්රිය වායු වින්යාසය ලබා ගනියි. එබැවින් H– හැර අනෙක් ඇනායන වල බාහිර උපශක්ති මට්ටමේ ඉලෙක්ට්රෝන 6ක් ඇත.
උදා : x හා y නම් මූලද්රව්ය 02ක් x2- , Y3- නම් ඇනායන සාදයි.මෙම ඇනායන වල බාහිර උපශක්ති මට්ටමේ ඉලෙක්ට්රෝන nx හා ny ආකාර වේ නම් සත්ය වනුයේ,
i)nx = ny = 8 ii) nx = ny = 8 iii) nx = ny = 6 iv) nx = ny = 6
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.


Physics වල ධාරා විද්යුතය පාඩමෙ resource book එක පැහැදිලි නැනේ…