17 කාණ්ඩය (ns2np5)
F – ලා කහ පැහැති විෂ සහිත වායුවකි.
Cl – ළා කොළ පැහැයට හුරු විෂ සහිත වායුවකි.
Br – රතු දුඹුරු පැහැති ද්රව්යයකි.
I – දිලිසෙන සුළු අළු පැහැති ඝණනකි. රත් කළ විට ක්රමයෙන් ඌර්ධවපාතනය වී දම් පැහැති වාෂ්පයක් සාදයි.
At – කෙටි අර්ධ ජීව කාලයක් සහිත විකිරණශීලි මූල ද්රව්යයකි.
- හැලජන -1,0,+1,+2,+3,+4,+5,+6,+7 යන ඔක්සිකරණ අවස්ථා පෙන්වයි. F වල විද්යුත් ඍණතාවය නිසා -1 හා 0 ඔක්සිකරණ අංක පමණක් පෙන්වයි.
- HCl අම්ලය ඔක්සිකාරකයක් සමඟ ප්රතික්රියා කිරීමෙන් Cl2 නිපදවයි.
- 2KMnO4(aq) + 16HCl(aq) → 2KCl(s)+ 2MnCl2(s) + 5Cl2(g) + 8H2O(l)
- MnO2(s) + 4HCl(aq) → MnCl2(aq) + 2Cl2(g) + 2H2O(l)
- PbO2(s) + 4HCl(aq) → PbCl2(aq) + 2Cl2(g) + 2H2O(l)
- KClO3(s) + 6HCl(aq) → KCl(aq) + 3Cl2(g) + 3H2O(l)
- K2Cr2O7(aq) + 14HCl(aq) → 2KCl(aq) + 2CrCl3(aq) + 3Cl2(g) + 7H2O(l)
- මීට අමතරව සෝඩියම් හේලයිඩයක් සා H2SO4 හා MnO2(මැන්ගනීස් ඩයොක්සයිඩ්) සමඟ රත් කිරීමෙන් ඕනෑම හැලජනයක් ලබාගත හැක.
- 2NaX(s) + සා. 3H2SO4(aq) + MnO2(s) → MnSO4(aq) + 2NaHSO4(aq) + X2(g) + 2H2O(l)
- 2NaBr(s) + සා. 3H2SO4(aq) + MnO2(s) → MnSO4(aq) + 2NaHSO4(aq) + Br2(g) + 2H2O(l)
- 2NaI(s) + සා. 3H2SO4(aq) + MnO2(s) → MnSO4(aq) + 2NaHSO4(aq) + I2(g) + 2H2O(l)
- කාණ්ඩයේ පහළට යත්ම පරමාණුක අරය වැඩි වන හෙයින් ස්වයං ප්රේරිත ද්විධ්රැව ඇතිවීමේ හැකියාව වැඩි වේ. එම නිසා අණු අතර පවතින අපකිරණ බල ප්රමාණය වැඩිවේ. තවද සාපේක්ෂ අණුක ස්කන්ධය ද ඉහළ යන විට අපකිරණ බල වල ප්රබලතාවය වැඩි වේ.එම නිසා කාණ්ඩයේ පහළට යත්ම ද්රවාංක සහ තාපාංක ක්රමයෙන් ඉහළ යයි.
- හැලජන වල ns2np5 ඉලෙක්ට්රොනික වින්යාසය නිසා එක් ඉලෙක්ට්රෝනයක් පිටතින් ලබා ලබාගෙන -1 අයන සාදයි.
- X + e → X¯
- කාණ්ඩයේ පහළට යත්ම පරමාණුක අරය වැඩි වන හෙයින් ඉලෙක්ට්රෝනයක් ග්රහණය කර ගැනීමේ හැකියාව අඩු වේ.එනිසාම කාණ්ඩයේ පහළට යත්ම හැලජනවල ප්රතික්රියාශීලීත්වය ක්රමයෙන් අඩු වේ.එම නිසා කාණ්ඩයට පහළින් වූ හැලජනයක ලවණ ද්රාවණයකින් එකී හැලජනය විස්ථාපනය කරවීමට ඉහළින් වූ හැලජනයට හැකිය.
- 2KI(aq) + Br2(g) → 2KBr(aq) + I2(s)
- 2KBr(aq) + Cl2(g) → 2KCl(aq) + Br2(aq)
හැලජන ජලය සමඟ ප්රතික්රියාව
- F2 ජලය සමඟ ප්රතික්රියාවෙන් HF අම්ලය සාදයි. ප්රතික්රියාව අධික ලෙස තාපදායක වේ.
- F2(g) + 2H2O(l) → 4HF(aq) + O2(g)
- Cl2 ජලයට යෙදූ විට එයින් කොටසක් ජලයේ දියවී කොළවන් කහ පැහැති ද්රවණයක් සාදයි. අනෙක් කොටස ජලය සමඟ ප්රතික්රියා කර HCl හා HOCl ලෙස ද්විධාකරණය වේ. ඉහත HOCl අම්ලය ප්රබල ඔක්සිකාරකයකි. එමඟින් බැක්ටීරියා වල අඩංගු රසායනික ද්රව්ය ඔක්සිකරණයට ලක් කරන නිසා ජීවානුහරණය සඳහා Cl2 වායුව යොදා ගනී.එසේම විරංජන කාරකයක් ලෙසද යොදා ගැනේ.
- තවද හිරු එළිය ඇති විට HOCl අම්ලය HCl හා O2 බවට වියෝජනය වේ. මේ නිසා හිරු එළිය ඇති විට Cl2 හා ජලය අතර ප්රතික්රියාවේ ඵලය වන්නේ O2 හා HCl ය.
- Cl2(g) + H2O(l) → HCl(aq) + HOCl(aq)
- 2HOCl(aq) → 2HCl(aq) + O2(g)
- 2Cl2(g) + 2H2O(l) → 4HCl(aq) + O2(g)
- Br2, Cl2 ට වඩා ජලයේ දිය වේ. නමුත් එය ද ජලය සමඟ සුළු වශයෙන් ප්රතික්රියා කරයි.
- Br2(l) + H2O(l) → HOBr(aq) + HBr(aq)
- I2 ඉතාමත් සුළු වශයෙන් ජලයේ දියවී දුඹුරුවන් කහ පැහැති ද්රාවණයක් සාදයි. I2 හොඳින්ම දියවන්නේ ජලීය KI ද්රාවණයකයි.එවිට දුඹුරු පැහැති (KI3) ද්රාවණයක් ලැබේ.
- I¯(aq) + I2(s) → I3¯(aq)
හයිඩ්රජන් හේලයිඩ (HX)
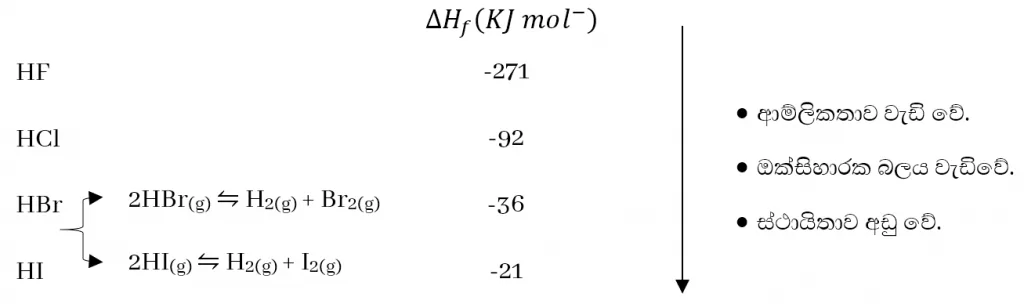
- හයිඩ්රජන් හේලයිඩ සියල්ලම ජලයේ හොඳින් දියවෙන, කටුක ගන්ධයක් සහිත නිර්වර්ණ වායූන් වේ.
- HF වල H බන්ධන නිසා ද්රවාංක හා තාපාංක අසාමාන්ය ලෙස ඉහළ අගයක් ගනී.
- HI හා HBr රත් කලවිට අමුද්රව්ය බවට වියෝජනය වේ.
- මේවා ජලීය ද්රාවණ වල දී අයණීකරණය වී ආම්ලික ගුණ දක්වයි.
- HX + H2O(l) → H3O+(aq) + X¯(aq)
- CaF2 හා NaCl සමඟ H2SO4 එක්කිරීමෙන් HF හා HCl සාදාගත හැක. නමුත් HBr හා HI වල ප්රබල ඔක්සිහාරක ගුණ නිසා ඉහත ආකාරයට ඒවා Br2 හා I2 ලෙස ඔක්සිකරණය වේ. මෙම නිසා HBr හා HI සාදා ගැනීම සිදුකරන්නේ පොස්පරස් ට්රයිබ්රෝමයිඩ (PBr3) හා පොස්පරස් ට්රයිඅයඩයිඩ(PI3) මත ජලයේ ක්රියාවෙනි. පොස්පරික් අම්ලය(H3PO4) NaBr සහ NaI සමඟ ප්රතික්රියා කරවීමෙන් ද HBr හා HI ලබා ගනියි .
- CaF2(s) + H2SO4(aq) → CaSO4(aq) + 2HF(l)
- NaCl(aq) + සා. H2SO4(aq) → NaHSO4(aq) + HCl(g)
- 2NaBr(s) + 3H2SO4(aq) → Br2(g) + SO2(g) + 2H2O(l)
- PBr3(s) + 3H2O(l) → H3PO3(aq) + 3HBr(g)
- PI3(s) + 3H2O(l) → H3PO3(aq) + 3HI(g)
- සා. H3PO4(aq) + NaBr(s) → HBr(g) + NaH2PO4(aq)
- සා. H3PO4(aq) + NaI(s) → HI(g) + NaH2PO4(aq)
Cl හි ඔක්සො අම්ල
- Cl +1, +3, +5, +7 යන ඔක්සිකරණ අංක වලට අයත් ඔක්සො අම්ල හතරක් පෙන්වයි.
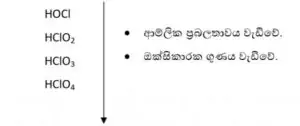
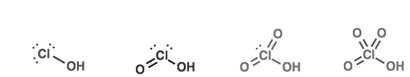
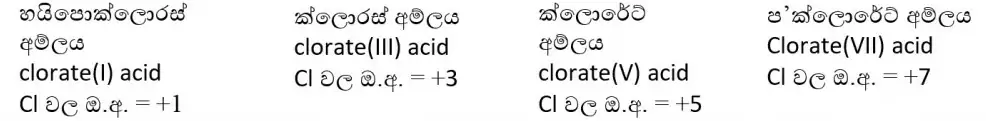
- ආම්ලික ප්රබලතාවය වැඩි වීමට Cl හි ඔක්සිකරණ අංකය වැඩිවීම සහ H+ ඉවත් වූ විට සෑදෙන ඇනායනයේ ස්ථායිතාව ඉහළ යාම හේතු වේ.
හැලජන භෂ්ම සමඟ ප්රතික්රියාව
- සිසිල් තනුක භෂ්ම සමඟ
- සිසිල් තනුක NaOH ද්රාවණයකට Cl2 යැවූ විට NaOCl හා NaCl ලෙස Cl2 ද්විධාකරණය වේ.
- Cl2(g) + 2NaOH(aq) → NaCl(aq) + NaOCl(aq) + H2O(l)
- සිසිල් තනුක NaOH ද්රාවණයකට Cl2 යැවූ විට NaOCl හා NaCl ලෙස Cl2 ද්විධාකරණය වේ.
- උණු සාන්ද්ර භෂ්ම සමඟ
- ඉහළ උෂ්ණත්වයේදී (80 ℃) OCl¯ අයනය Cl¯ හා ClO3¯ බවට ද්විධාකරණය වේ.
- 3OCl¯(aq) → 2Cl¯(aq) + ClO3¯(aq)
- 3Cl2(g) + 6NaOH(aq) → NaCl(aq) + NaClO(aq) + 3H2O(l)
- Br2 හා I2 සිසිල් තනුක හා උණු සාන්ද්ර භෂ්ම සමඟ ඉහත ආකාරයෙන්ම හැසිරේ.
- 3Br2(g) + 6NaOH(aq) → 5NaBr(aq) + NaBrO3(aq) + 3H2O(l)
- F2 භෂ්ම සමඟ පහත ආකාරයට ප්රතික්රියා කරයි.
- 2F2(g) + 2NaOH(aq) → OF2(g) + 2NaF(aq) + H2O(l)
- ඉහළ උෂ්ණත්වයේදී (80 ℃) OCl¯ අයනය Cl¯ හා ClO3¯ බවට ද්විධාකරණය වේ.
හැලජන වල ඔක්සිකාරක ගුණ
- 2NH3(g) + 3Cl2(g) → N2(g) + 6HCl(g)
- ඉහත අවස්ථාවේදී NH3 වැඩිපුර වූයේ නම් සුදු පාට දුමාරයක් ලෙස NH4Cl සෑදෙයි.
- වැඩිපුර 8NH3(g) + 2Cl2(g) → N2(g) + 6NH4Cl(s)
- මෙහිදී Cl2 වැඩිපුර වූයේ නම් NCl3 ලැබේ.
- NH3(g) + වැඩිපුර 3Cl2(g) → NCl3(s) + 3HCl(g)
- Br2 සහ I2 සමඟ ද මෙලෙසම ප්රතික්රියා කරයි.
- NH3(g) + 3Br2(l) → NBr3(s) + 3HBr(g)
- ඉහත අවස්ථාවේදී NH3 වැඩිපුර වූයේ නම් සුදු පාට දුමාරයක් ලෙස NH4Cl සෑදෙයි.
- හැලජන මගින් H2S, S බවට ඔක්සිකරණය වේ.
- H2S(g) + Cl2(g) → 2HCl(g) + S(s)
- හැලජන ලෝහ සමඟ ප්රතික්රියාවෙන් ඔක්සිකරණය වී හේලයිඩ සාදයි. මේවා සමහරක් විශාල තාප ප්රමාණයක් මුදාහරින උග්ර ප්රතික්රියා වේ.
- F2(g) + 2Na(s) → 2NaF(s)
- 2Na(s) + Cl2(g) → 2NaCl(s)
- Cu(s) + Cl2(g) → CuCl2(s)
- 2Fe(s) + 3Cl2(g) → 2FeCl3(s)
- Zn(s) + Cl2(g) → ZnCl2(s)
- අලෝහ වැඩි සංඛ්යාවක් හැලජන සමඟ ප්රතික්රියා කර සහසංයුජ බන්ධන සහිත අණුවලින් යුත් සංයෝග සාදයි.
- 2P(s) + 3Cl2(g) → 2PCl3(s)
- 2P(s) + 5Cl2(g) → 2PCl5(s)
14 හා 15 කාණ්ඩවල ක්ලෝරයිඩ වල ජලවිච්ඡේදනය
- SiCl4(l) + 4H2O(l) → 4HCl(aq) + Si(OH)4(aq)
- SiCl4(l) + 2H2O(l) → 4HCl(aq) + SiO2(s)
- PCl3(l) + 3H2O(l) → H3PO3(aq) + 3HCl(aq)
- PCl5(s) + 4H2O(l) → H3PO4(aq) + 5HCl(aq)
- PCl5(s) + H2O(l) → POCl3(aq) + 2HCl(aq)
- NCl3(g) + 3H2O(l) → NH3(aq) + 3HOCl(aq)
- SbCl3(s) + H2O(l) ⇌ SbOCl(s) + 2HCl(aq)
- AsCl3(s) + 3H2O(l) ⇌ H3AsO3(aq) + 3HCl(aq)
- BiCl3(s) + H2O(l) ⇌ BiOCl(s) + 2HCl(aq)
- කාබන් ක්ලෝරයිඩ කිසිවක් කාමර උෂ්ණත්වයේ දී ජලවිච්ඡේදනය නොවේ.
- 15 කාණ්ඩයේ පහළට යත්ම ක්ලෝරයිඩ වල ජලවිච්ඡේදනය හැකියාව අඩුවේ. එසේ වන්නේ ක්ලෝරයිඩ්(Cl-X) බන්ධන වල අයනික ස්වභාවය පහළට යත්ම වැඩි වන හෙයිනි.

