Sc – Scandium – 1s22s22p63s23p63d14s2

- ආන්තරික වේ.
- විචල්ය සංයුජතා නොමැත. ප්රතික්රියාශීලිත්වය ඉහළය.
- 2Sc(s) + 6H2O(l) → 2Sc(OH)3(s)🠓 + 3H2(g)
Ti – Titanium – 1s22s22p63s23p63d24s2

- සුදු තීන්ත නිෂ්පාදනය, ගුවන් යානා අමතර කොටස් නිෂ්පාදනය වැනි කාර්මික නිපදවීම් සදහා යොදාගනු ලබන ලෝහයක් වන Ti සඳහා ඉහළ කාර්මික ඉල්ලුමක් පවතී. ඉල්මනයිට් හා රූටයිල් ස්වරූපයෙන් ටයිටේනියම් ස්වභාවයේ පවතී. ශ්රී ලංකාවේ පුල්මුඩේ වෙරළ තීරය තුළ මෙම ඛනිජය දැකගත හැක.
- ඉල්මනයිට් : TiO2.FeO(කළු)
- රූටයිල් : TiO2(සුදු)
- ඝන ටයිටේනියම්, ක්ලෝරීන් වායුව සමඟ රත් කලවිට අවර්ණ ටයිටේනියම් ටෙට්රාක්ලෝරයිඩ් (TiCl4) වායුව සාදයි.
- Ti(s) + 2Cl2(g) → TiCl4(g)
- මෙලෙස සෑදෙන TiCl4 වායුව කාමර උෂ්ණත්වයට පත් වීමේදී TiCl4 ද්රවය බවට පත් වේ.මෙම TiCl4 ද්රවය රසායනික වශයෙන් ප්රතික්රියාශීලී වන අතර විවිධ ද්රව්ය සමඟ විවිධ ආකාර වලින් ප්රතික්රියා කරයි.
- Ti සමඟ රත් කළවිට ඝන අයනික සංයෝගයක් වන TiCl2 ලබාදේ.
- Ti(s) + TiCl4(l) → 2TiCl2(s)↓
- ජලය සමඟ එකතු කළ විට සුදු පැහැති අවකේෂ්පයක් ලබාදේ.
- TiCl4(l) +2 H2O(l) → TiO2(s)↓ + 4HCl(g)
- ආම්ලික මාධ්යයක දී දම් පැහැති සංකීර්ණ සංයෝගයක් Zn සමග ප්රතික්රියාවෙන් ලබාදෙයි.
- 2Ti4+(aq) + Zn(s) → 2Ti3+(aq) + Zn2+(aq)
- සාන්ද්ර HCl එකතු කළ විට අවර්ණ සංකීර්ණයක් ලබා දෙයි.
- TiCl4(l)+ 2Cl–(aq) → [TiCl6]2-(aq)
- TiCl4 යනු අණුක භාරය වැඩි සංයෝගයක් වුවද එය ද්රවයක් ලෙස පැවැතීමටත් TiCl2 යනු අණුක භාරය අතින් අඩු සංයෝගයක් වුවද එය ඝනයක් ලෙස පැවතීමටත් හේතුව Ti4+ අයනය ට සාපේක්ෂව Ti2+ අයනය ධ්රැවීකරණ බලයෙන් අඩු බැවින් එම නිසා TiCl2 හි ගැබ්වන අයනික ලක්ෂණ ප්රතිශතය TiCl4 ඊට සාපේක්ෂව ඉහළ වීමයි.
V – Vanadium – 1s22s22p63s23p63d34s2

- පොළව මතුපිට පවතින දුර්ලභ ලෝහ මූලද්රව්යයක් වන අතර ශුන්ය අවස්ථාවට අමතරව +2, +3, +4, හා +5 යන ඔක්සිකරණ අංක වලින් යුතු සංයෝග සාදයි.ඒ අතරින් +4, +5 වඩාත් සුලභ ඔක්සිකරණ අංක වේ. V හි ඔක්සයිඩයක් වන V2O5 ස්පර්ශ ක්රමයෙන් සල්ෆියුරික් නිපදවීමේදී උත්ප්රේරකයක් ලෙස යොදා ගැනේ. මිශ්ර ලෝහ නිෂ්පාදනයට ද V ප්රයෝජනයට ගැනේ.
- V හි ඔක්සයිඩ හා අයන කීපයක් පවතී.
| +2 | +3 | +4 | +5 | |
| V හි අයන | V2+ දම් | V3+ කොළ | VO2+ නිල් | VO2+ කහ |
| V හි ඔක්සයිඩ | VO අළු භාෂ්මික |
V2O3 කළු භාෂ්මික |
VO2 තද නිල් උභයගුණි |
V2O5 තැඹිලි/කහ ආම්ලික |
- V වැඩිපුර O2 තුළ දහනයෙන් හෝ NH4VO3 තාප වියෝජන යෙන් තැඹිලි පාට V2O5 ලබා ගත හැක.
- 4V(s) + 5O2(g) → 2V2O5(s)↓
- 2NH_4VO_{3(s)}\xrightarrow[ᐃ]{}\;V_2O_{5(s)}\downarrow\;+\;2NH_{3(g)}\;+H_2O_{(g)}
- V2O5 අම්ල තුළ දියවීමෙන් කහ පාට VO2+ අයන අන්තර්ගත ද්රාවණ ද, භෂ්ම තුළ දියවීමෙන් කහ පාට VO43- අයන අන්තර්ගත ද්රාවණ ද ලබා දෙයි.
- V2O5(s) + 2H+(aq) → 2VO2+(aq) + H2O(l)
- V2O5(s) + 6OH¯(aq) → 2VO43-(aq) + 3H2O(l)
- V2O5 සල්ෆර්ඩයොක්සයිඩ් හමුවේදි තද නිල් පැහැති VO2 බවට ඔක්සිහරණය වේ.
- V2O5(s) + SO2(g) → 2VO2(s)↓ + SO3(g)
- VO2 උභයගුණී වන අතර අම්ලවල ද්රාවණය වූ විට නිල් පැහැති ජලීය VO2+ අයන සාදයි.
- VO2(s)+ 2H+(aq) → VO2+(aq) +H2O(l)
- මෙලෙස ආම්ලික මාධ්යයක් තුළ ජනනය වන නිල් පැහැති VO2+ (V4+) අයන Zn කුඩු හමුවේ දී කොළ පැහැති V3+ බවට ඔක්සිහරණය වේ.
- 2V4+(aq) + Zn(s) → 2V3+(aq) + Zn2+(aq)
- මෙලෙස ජනනය වන කොළ පැහැති V3+ අයන තවදුරටත් Zn කුඩු හමුවේ දී V2+ බවට ඔක්සිහරණය වේ. V2+ ජලීය ද්රාවණයක් දම් පැහැතිය.
- 2V3+(aq) + Zn(s) → 2V2+(aq) + Zn2+(aq)
Cr – Chromium – 1s22s22p63s23p63d54s1

- ඒ තරම් සුලබ නොවන ලෝහ විශේෂයක් වන ක්රෝමියම් මිශ්ර ලෝහ වර්ග නිපදවීමේදී බහුලව ප්රයෝජනයට ගැනේ.
- ක්රොමියම්හි ශුන්ය අවස්ථාවට අමතරව +2, +3, +4,+5, +6 යන ඔක්සිකරණ අවස්ථා පවතින අතර ඉන් +2, +3 හා +6 සුලභව පෙන්වන ඔක්සිකරණ අවස්ථා වේ.
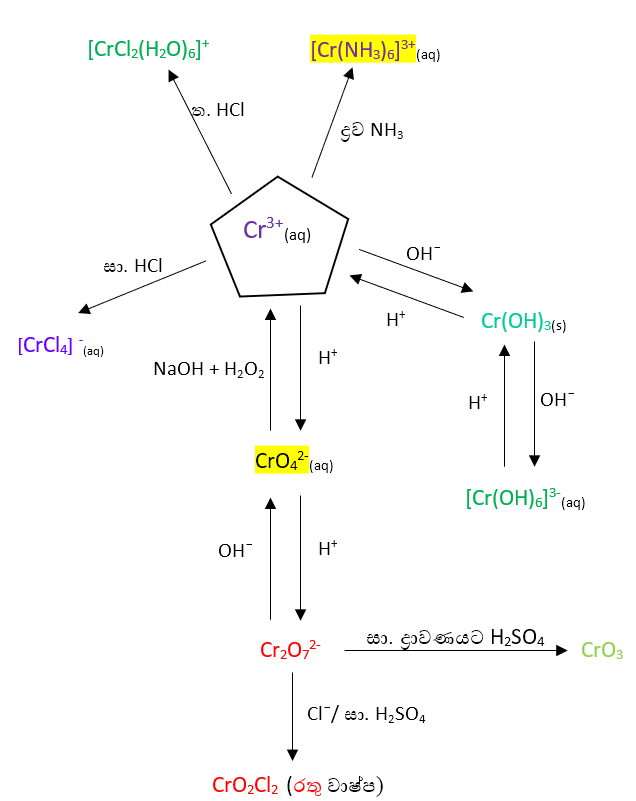
- ක්රෝමියම් තනුක අම්ල තුළ ද්රාවණය වී නිල් පැහැති Cr2+ අයනයේ ජලීය ද්රාවණයක් ලබා දේ. අමතරව හයිඩ්රජන් වායුව ද විස්ථාපනය කරයි.
- Cr(s) + 2H+(aq) → Cr2+(aq) + H2(g)
- මෙම නිල් පැහැති Cr2+ ජලීය ද්රාවණය H2O2 වැනි ඔක්සිකාරක හමුවේ දී දම් පැහැති Cr3+ ජලීය ද්රාවණයක් බවට පත් වෙයි.
- 2Cr2+(aq) + H2O2(l) + 2H+(aq) → 2Cr3+(aq) + 2H2O(l)
- මෙම Cr3+ ජලීය ද්රාවණය ආම්ලික මාධ්යයක දී අම්ලවලින් ලැබෙන ඇනායන සමග සංකීර්ණ සංයෝග සෑදීමෙන් කොළ පැහැයට හැරේ.
- [Cr(H2O)6]3+(aq) + Cl¯(aq) → [CrCl(H2O)5]2+(aq) +H2O(l)
- මෙම Cr3+ අඩංගු ජලීය ද්රාවණයකට ජලීය ඇමෝනියා එකතු කරන විට වැඩිපුර ජලීය ඇමෝනියා හි අද්රාව්ය නිල් කොළ පැහැති අවකේෂ්පයක් ලැබෙන අතර ද්රව ඇමෝනියා එකතු කරන විට කහ පැහැති සංකීර්ණ සංයෝගයක් සාදයි.
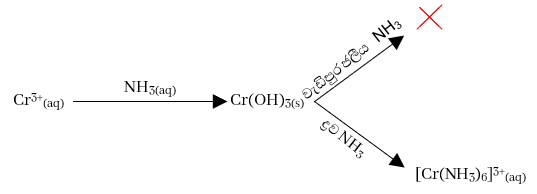
- Cr3+ ජලීය ද්රාවණයක් ක්ෂාරීය මාධ්යයක දී කහ පැහැති CrO42¯ බවට ඔක්සිකරණය වේ. මේ සඳහා අවශ්ය ඔක්සිකාරකය ලෙස H2O2 වැනි ප්රභේද යොදා ගැනේ.
- Cr3+(aq) + 8OH–→ CrO42¯(aq) + 3e + 4H2O(l)
- 2e +H2O2(aq) → 2OH–
- 10OH¯(aq)+ 2Cr3+(aq) + 3H2O2(aq) → 2CrO42¯ (aq) + 8H2O(l)
- Cr3+ ජලීය ද්රාවණයක් Cl¯ අයන හමුවේ දී නිල් දම් පැහැති සංකීර්ණයක් සාදයි.
- Cr3+(aq) + 4Cl¯(aq) → [CrCl4]¯(aq)
- Cr3+ අන්තර්ගත ජලීය ද්රාවණයකට ප්රබල භෂ්මයක් ක්රමයෙන් එකතු කරන විට නිල් කොළ පැහැති අවකේෂ්පයක් සෑදෙන අතර වැඩිපුර භෂ්මය එකතු කරනවාත් සමග එම නිල් කොළ පැහැයෙන් ඇති අවකේෂ්පය දිය වී කොළ පැහැති ද්රාවණයක් සෑදෙනු ඇත.
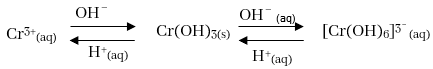
- Cr යනු උභයගුණි නොවන ලෝහයක් වුවද Cr3+ විසින් සාදන OH¯ අවක්ෂේපය ක්රම ක්රමයෙන් වැඩිවන සේ OH– එකතු කිරීමේදී, ප්රබල භෂ්මයක ද්රාව්ය වීමෙන් පැහැදිලි වන්නේ Cr3+ අවස්ථාව උභයගුණී වන බවයි.
- ආම්ලික K2Cr2O7 සමඟ H2O2 ප්රතික්රියා කර Cr3+ සෑදීමේදී අතරමැදියක් ලෙසට නිල් පැහැති CrO5 (CrO(O2)2) සංයෝගය ලැබේ.මෙම පෙරොක්සො සංයෝගය ඉතා පහසුවෙන් Cr3+ සාදමින් O2 පිට කරමින් වියෝජනය වේ.
- ක්රොමියම්හී ඔක්සයිඩ

- Cr3+ අයන, K2Cr2O7 හා H2O2 වැනි ඒවා සමඟ ප්රතික්රියාවෙන් සෑදෙන විට අතරමැදියක් ලෙසට නිල් පැහැති CrO5 සංයෝගය ලැබේ.
Mn – Manganese – 1s22s22p63s23p63d54s2

- මිශ්ර ලෝහ නිපදවීමේදී යොදාගනු ලබන ලෝහයක් වන අතර අළු පැහැති ස්වභාවයක් ගනී. MnO2 හා MnCO3 වැනි සංයෝග වල ස්වරූපයෙන් Mn ස්වභාවයෙන් පවතී. තරමක් ඉහළ ප්රතික්රියාශීලීත්වයක් පවතින අතර රත් කල විට O2, N2 හා Cl2 වැනි ප්රභේද සමඟ ප්රතික්රියා කර MnO2, Mn3N2 හා MnCl2 වැනි සංයෝග සාදයි.
- Mn තනුක අම්ල තුළ පහසුවෙන් දිය වී හයිඩ්රජන් වායුව ලබා දෙයි. තව ද රෝස පැහැති Mn2+ ජලීය ද්රාවණයක් ලබා දෙයි.
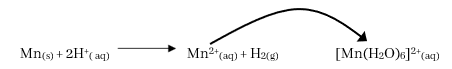
- Mn2+ අයන ජලීය ද්රාවණයක දී Cl¯ අයන සමඟ කොළ කහ මිශ්ර පැහැති සංකීර්ණයක් සාදයි.
- Mn2+(aq) + 4Cl¯ (aq) → [MnCl4]¯(aq)
- මෙලෙස සෑදෙන Mn2+ ජලීය ද්රාවණයකට NaOH එකතු කරන විට ලා කහ සුදු පැහැයට හුරු අවක්ෂේපයක් ලැබේ. එම අවක්ෂේපය වැඩිපුර NaOH හමුවේ දිය නොවේ.
- Mn2+(aq) + 2OH¯ (aq) → Mn(OH)2(s)↓
- Mn2+ ජලීය ද්රාවණයකට NH3(aq) බිංදු වශයෙන් එකතු කරන විටද ලා කහ සුදු පැහැයට හුරු Mn(OH)2(s) ලැබේ.එයද වැඩිපුර NH3 හමුවේ දිය නොවේ.
\;\;\;\;\;{\mathrm{Mn}^{2+}}_{(\mathrm{aq})\;}\;+\;\;2{\mathrm{NH}}_{3(\mathrm{aq})}\;+\;\;\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\rightarrow\;\;\mathrm{Mn}(\mathrm{OH})_{2(\mathrm{aq})}\;\;+\;\;2{\mathrm{NH}_4^+}_{(\mathrm{aq})}
- ඉහත සෑදෙන ලා කහ සුදු පැහැති අවක්ෂේපය වායුගෝලයට නිරාවරණය වූ විට පහසුවෙන් ම කළු දුඹුරු පැහැයට හැරේ.සියලුම ලෝහ හයිඩ්රොක්සයිඩ අතරින් O2වලට වඩාත්ම සංවේදි වන්නේ Mn(OH)2 ය.
- 2Mn(OH)2(s) + O2(g) → 2MnO2(s) +2H2O(l)
- ඉහත සෑදෙන කළු දුඹුරු පැහැති අවක්ෂේපය ආම්ලික මාධ්යකදී ඔක්සිකාරකයක් ලෙස ක්රියා කරන අතර I¯, Fe2+, Cl¯, Br¯ වැනි ප්රභේද මගින් ඔක්සිකරණය වේ.
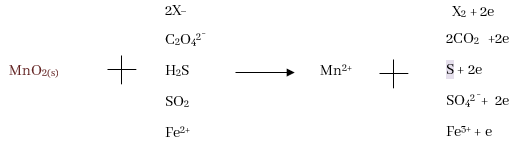
- කෙසේ වුවත් තනුක HNO3 වලින් ආම්ලික කළ BiO3¯ මඟින් රෝස පැහැති Mn2+ සෘජුවම දම් පැහැති MnO4¯ බවට ඔක්සිහරණය වේ.

- MnO4¯ අයන ප්රබල ඔක්සිකාරකයක් වන අතර එමගින් C2O42-, H2S, H2SO3, Fe2+, I– වැනි ප්රභේද ඔක්සිකරණය වේ.
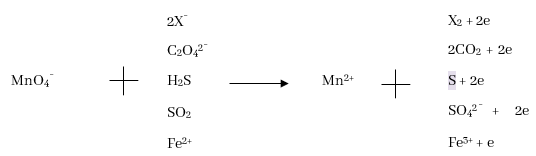
- MnO4¯ ප්රබල ක්ෂාරයක් හමුවේ දී කොළ පැහැති MnO42- අයන බවට ඔක්සිහරණය වේ.

- MnO42¯ ක්ෂාරීය මාධ්යයේ දී පමණක් ස්ථායි වන අතර මාධ්ය ආම්ලික කළ විට කළ විට දම් පැහැති MnO4¯ හා දුඹුරු පැහැති MnO2 බවට ද්වීධාකරණය වේ.

මෙලෙස එකම මූලද්රව්යයක් ඔක්සිකරණයට හා ඔක්සිහරණයට භාජනය වීම ද්විධාකරණය නමින් හඳුන්වයි.
- මැංග්නීස් හි ඔක්සයිඩ


ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

