- මෙහිදී වරණීය ලෙස කැටායන අවක්ෂේප කරමින් ප්රධාන විශ්ලේෂණ කාණ්ඩ පහකට ගොනු කරයි.
- ද්රාව්යතා ගුණිත මත පදනම්ව කැටායන වෙන් කිරීම මෙහිදී සිදුවේ.
- අවකේෂ්ප වීම හෝ ද්රාව්ය වීම යනු එකම ප්රතික්රියාවේ දෙපස වේ.
තාපය + MX(s) ↔ M+(aq) + X–(aq)
- මෙම ද්රාව්ය වීම හෝ අවක්ෂේප වීම සඳහා බලපාන සාධක කිහිපයකි,
-
උෂ්ණත්වය
- උෂ්ණත්වය වැඩි කළ විට ඉහත ප්රතික්රියාවෙන් තාප අවශෝෂක ඉදිරි ප්රතික්රියාව සීඝ්ර වේ. එනම් ජල ද්රාව්යතාවය වැඩි වේ.
-
මාධ්යයේ ඇති වෙනත් අයන
H+ අයන
- ඉහත X– (aq) දුබල අම්ලයකින් ලැබෙන ඇනායනයක් නම්,
{ F¯(aq) / OH¯(aq) / CO32-(aq) / SO32-(aq) / C2O42-(aq) / PO43-(aq) / X¯(aq) }
- ඉහත අවක්ෂේප සහිත මාධ්යයට අම්ලයක් එක් කළ විට මෙම H+ සමග එක්වී HX සාදයි. HX හි විඝටනය ඉතා අඩු නිසා මෙහිදී X¯කොටසක් පද්ධතියෙන් ඉවත් වෙයි.
MX(s) → M+(aq) + X¯(aq) ——–1
H+(aq) + X¯(aq) ⇋ HX(aq) ——–2
- මෙසේ X¯ ලෙස ඉවත් වන නිසා 1 පද්ධතියට ඒ බලපෑමක් කර 1 ඉදිරියට සීඝ්ර වේ. එනම් MX හි ජල ද්රව්යතාව වැඩි වේ.
NH3 / CN– වැනි බන්ධ කාණ්ඩ
- ඉහත අයනයට මෙම බන්ධ කාණ්ඩ සමග සංගත සංකීර්ණ සෑදිය හැකි නම් අයන සංගත සංකීර්ණය ලෙස ද්රාවණයෙන් ඉවත් වේ.
MX(s) → M+(aq) + X¯(aq) ——–1
M+(aq) + nNH3(aq) → [M(NH3)n]+(aq) ——– 2
- M+(aq) අයන මාධ්යයෙන් ඉවත් වී 1 පද්ධතියට බලපෑමක් කර ඉදිරි ප්රතික්රියාව සීඝ්ර වේ. එනම් ලවණ ජලයේ ද්රාව්ය වේ මේ හේතුව නිසා ම d7, d8, d9, d10 ඉලෙක්ට්රොනික වින්යාසයන් ඇති කැටායන වල හයිඩ්රොක්සයිඩ වැඩිපුර ඇමෝනියා වල දිය වේ.
- ගුණාත්මක විශ්ලේෂණයේදී කැටායන කාණ්ඩ 5 කට බෙදා ඇත්තේ පහත ආකාරයට වේ.
පළමුවන කැටායන විශ්ලේෂණ කාණ්ඩය
- මෙහි දී අඩු Cl¯ අයන සාන්ද්රණයක් අවශ්ය ක්ලෝරයිඩ අවක්ෂේප කරයි. මේ සඳහා කැටායන සහිත ජලීය ද්රාවණයකට සිසිල් තනුක HCl වැඩිපුර එකතු කරයි. එවිට ද්රාව්යතා ගුණිතය එතරම් විශල නොවන පහත කැටායන ක්ලෝරයිඩ ලෙස අවක්ෂේප වේ.
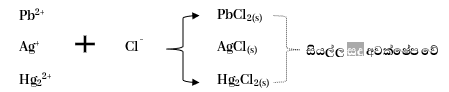
- මෙහි දී Pb2+ අයන සියල්ලම අවක්ෂේප කිරීමට වැඩි Cl¯ අයන ප්රමාණයක් අවශ්ය වේ යැයි උපකල්පනය කරද ඒ සඳහා සාන්ද්ර HCl භාවිතා කළ නොහැක. එයට හේතු වන්නේ සාන්ද්ර HCl, PbCl2 සමඟ [PbCl4]2-, [PbCl3]¯ බවට පත් වී ද්රාවණ ගත වීමයි. එම නිසා Pb2+ කොටසක් දෙවන කැටායන විශ්ලේෂණ කාණ්ඩයට යයි.
දෙවන කැටායන විශ්ලේෂණ කාණ්ඩය
- පළමු වන කැටායන විශ්ලේෂණ කාණ්ඩයේ අවක්ෂේප පෙරා පෙරණයට ජලය දමා HCl සාන්ද්රණය 0.1-0.2 moldm3- වන තෙක් සකස් කර එයට H2S යවයි. එවිට මාධ්ය පහත සමතුලිතතාව ඇති වේ. අඩු H2S සාන්ද්රණයක් යොදාගනියි.
HCl(aq) → H+(aq) + Cl¯(aq) ——–1
H2S(aq) ⇋ 2H+(aq) + S2-(aq) ——–2
- 1 ප්රතික්රියාවෙන් ප්රබලව H+(aq) ලැබෙන නිසා 2 පද්ධතියට එය බලපෑමක් කර 2 පද්ධතිය පිටුපසට නැඹුරු කරයි. එවිට මාධ්යයේ S2- අයන සාන්ද්රණය අඩුවෙයි. මේ නිසා මෙහිදී අඩු අයන සාන්ද්රණයක් අවශ්ය පහත අයන පමණක් අවක්ෂේප වේ.(එනම් ද්රාව්යතා ගුණිතය Ksp කුඩා වන ලෝහ සල්ෆයිඩ අවක්ෂේප වේ.)
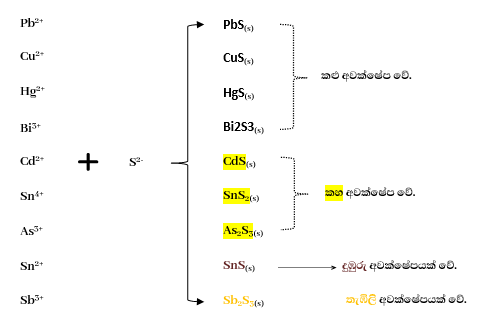
- මෙහි දී වැඩිපුර සල්ෆයිඩ අයන සාන්ද්රණයක් අවශ්ය Ni2+, Zn2+ අයන වැනි අයන අවක්ෂේප නොවේ.
තුන්වන කැටායන විශ්ලේෂණ කාණ්ඩය
- මෙහිදී අඩු OH– අයන සාන්ද්රණය අවශ්ය හයිඩ්රොක්සයිඩ අවක්ෂේප වේ. දෙවන කැටායන විශ්ලේෂණයේ අවක්ෂේප පෙරා පෙරණය පළමුව හොඳින් රත්කරයි. එවිට H2S ඇත්නම් ඒවා පෙරණයෙන් ඉවත් වෙයි. ඉන්පසු සාන්ද්ර HNO3 එකතු කර නැවත රත් කරයි. මෙහිදී ද්රාවණයේ Fe2+ තිබුණේ නම් ඒවා Fe3+ බවට පත්වේ.
- එසේ නොවුණේ නම් මෙහිදී Fe(OH)2 කොටසක් අවක්ෂේප වී කොටසක් පෙරණයට ගමන් කර හතරවන කැටායන විශ්ලේෂණ කාණ්ඩයට බාධා ඇති කරයි. මීට අමතරව මෙහිදී S2- අයන තිබුණේ නම් ඒවා H2S ලෙස පිටවේ .
- ඉන්පසු මෙම ද්රවණයට NH4Cl හා NH4OH එකතු කරයි. එවිට පද්ධතිය පහත සමතුලිතතාවයන් ඇති වේ.
NH4Cl(aq) → NH4+(aq) + Cl¯(aq) ——–1
NH4OH(aq) ⇋ NH4+(aq) + OH¯(aq) ——–2
- 1 ප්රතික්රියාවෙන් ප්රබලව NH4+(aq) අයන ලැබෙන නිසා 2 පද්ධතියට එය බලපෑමක් ඇතිකර 2 පිටුපසට නැඹුරු වෙයි. එවිට OH¯ අයන සාන්ද්රණය අඩු වන අතර එහිදී අවක්ෂේප වන්නේ අඩු OH¯(aq) අයන සාන්ද්රණයක් අවශ්ය පහත ඒවා පමණි. එනම් ksp කුඩා වන ලෝහ හයිඩ්රොක්සයිඩ පමණක් අවක්ෂේප වෙයි.
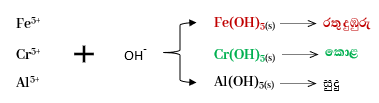
- මෙහිදී Mg(OH)2 වැනි ඒවාට අවශ්ය අයන OH¯(aq) සාන්ද්රණය නොලැබෙන නිසා ඒවා අවක්ෂේප නොවේ . Ni(OH)2,Cu(OH)2 වැනි ඒවා NH3 සමඟ සංගත සංකීර්ණ සාදන නිසා ඒවාද අවක්ෂේප නොවේ.
හතරවන කැටායන විශ්ලේෂණ කාණ්ඩය
- තුන්වන කැටායන විශ්ලේෂණ කාණ්ඩයේ අවක්ෂේප පෙරා පෙරණයට H2S යවයි. එවිට ද්රාවණයේ ඇති OH¯ අයන H2S හි ඇති H+ සමග එක්වී ජලය සාදයි . එවිට S2-අයන සාන්ද්රණය වැඩි වෙන හෙයින් මෙහිදී වැඩි S2- අයන සාන්ද්රණයක් අවශ්ය සල්ෆයිඩ ද අවක්ෂේප විය හැක. 2 කාණ්ඩයේදී මෙන් නොව Ksp සාපේක්ෂව විශාල වන ලෝහ සල්ෆයිඩ තැන්පත් වේ.
2OH¯ + H2S(aq) → 2H2O(l) + S2-(aq)
H2S(aq) ⇋ 2H+(aq) + S2-(aq)
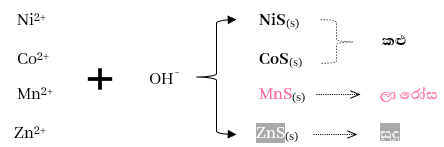
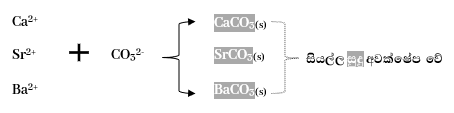
පස්වන කැටායන විශ්ලේෂණ කාණ්ඩය
- හතරවන කැටායන විශ්ලේෂණ කාණ්ඩයේ අවක්ෂේප පෙරා පෙරනයේ H2S ඉවත් වීම සඳහා හොඳින් රත් කරයි. ඉන්පසු NH4Cl ස්වල්පයක් හා NH4OH වැඩිපුර දමා (NH4)2CO3 එකතු කරයි.මෙහිදී පහත ඒවා සුදු පැහැයෙන් අවකේෂ්ප වේ. මෙහිදී අවක්ෂේප වන්නේ අඩු කාබනේට සාන්ද්රණයේදී , ද්රාව්යතා ගුණිතය Ksp කුඩා වන ලෝහ කාබනේටයි.
NH4Cl(aq) ⇋ NH4+(aq) + Cl¯(aq)
(NH4)2CO3(aq) ⇋ NH4+(aq) + CO32-(aq)
වැඩිදුර අධ්යනය සදහා ඉගැන්වීම් ,
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

