විද්යුත් රසායනික ශ්රේණිය
- මූලද්රව්යවල ජලීය ද්රාවණයේදී ඔක්සිහරණය වීමේ හැකියාව වැඩිවන පිළිවෙලට රසායනික ශ්රේණිය පිළියෙල කර ඇත.
- එය ඒ සඳහා Hට සාපේක්ෂව විභවය සලකා ඇත.
- ජලීය ද්රාවණයේදී ප්රබලතම ඔක්සිහාරකය Li වේ.නමුත් මූලද්රව්යමය අවස්ථාවේ ප්රබලතම ඔක්සිහාරකය Fr වේ.
- ජලීය ද්රාවණයේදීත් මූලද්රව්යමය අවස්ථාවේදීත් ප්රබලතම ඔක්සිකාරකය F වේ.

ලෝහවල විද්යුත් රසායනික ශ්රේණියේ පිහිටීම අනුව ස්වභාවයේ පැවැත්ම හා නිස්සාරණය පැහැදිලි කිරීම.
- විද්යුත් රසායනික ශ්රේණියේ ඉහලින්ම පිහිටන ප්රභල ඔක්සිහාරක වන Na, K, Ca … වැනි ලෝහ Cl–, SO42- ලෙස මුහුදු ජලයේ පවතී.
Ca, Mg … වැනි ලෝහ CO32- ලෙස ගොඩබිමද පවතී.
- මෙම ලෝහ නිස්සාරණය කරනුයේ අදාළ ලවණ වලින් ක්ලෝරයිඩය සාදා විද්යුත් විච්ජේදනය කිරීමෙනි.
- විද්යුත් රසායනික ශ්රේණියේ මැද භාගයේ පිහිටන මධ්යස්ථ ඔක්සිහාරක වන Fe, Co, Ni … වැනි ලෝහ ඔක්සයිඩ, සල්ෆයිඩ, කාබනේට ආදී ලෙස ලෝ පසතුල පවතී.
- මෙම ලෝහ නිස්සාරණය කරනුයේ ලෝපස වාතයේ කර කර ඔක්සයිඩය සාදා ධාරා ඌෂ්මකයක් තුළ C හෝ CO මගින් ඔක්සිහරණය කිරීමෙනි.
- විද්යුත් රසායනික ශ්රේණියේ පහළින්ම පිහිටන දුබල ඔක්සිහාරක වන Au, Ag, Pt … වැනි නිදහස් ලෝහ ලෙස ලෝපස තුළ අන්තර්ගත වේ.
- මෙම ලෝහ නිස්සාරණය කරනුයේ ලෝපස සා.KCN හි ද්රාවණය කර පසුව Zn කුඩු / Al කුඩු ආදිය එකතු කර විස්ථාපන ක්රමයෙනි.
Ag\;\mathrm{සහිත}\;\mathrm{ලෝපස්}\;\;\xrightarrow[{\mathrm{සා}.\mathrm{KCN}}]{}\;\lbrack\mathrm{Ag}(\mathrm{CN})_2\rbrack^-\;\xrightarrow[{\mathrm{Zn}\;\mathrm{කුඩු}}]{}\;\lbrack\mathrm{Zn}(\mathrm{CN})_4^{\rbrack2-}\;+\;\mathrm{Ag}\downarrow\;
- විද්යුත් රසායනික ශ්රේණියේ පහළින් පිහිටන ලෝහ කැටායන ද්රාවණයකට ඉහලින් පිහිටන නිදහස් ලෝහය යෙදූවිට ඉහල ලෝහයේ කැටායනය සෑදී පහළ ලෝහය විස්ථාපනය වේ.
C{u^{2+}}_{(aq)}\;+\;Zn_{(s)}\;\;\rightarrow\;\;Cu_{(s)}\;+\;Z{n^{2+}}_{(aq)}
- විද්යුත් රසායනික ශ්රේණියේ ඉහලින් පිහිටන ඇනායන ද්රාවණයකට පහළින් පිහිටන නිදහස් අලෝහය එකතු කල විට පහළ අලෝහයේ ඇනායනය සෑදී ඉහල අලෝහය විස්ථාපනය වේ.
2B{r^-}_{(aq)}\;+\;C{l_2}_{(g)}\;\;\rightarrow\;\;2C{l^-}_{(aq)}\;+\;B{r_2}_{(g)}\uparrow
- ජලයෙහි ඔක්සිකරණය

- ජලයෙහි ඔක්සිහරණය

විද්යුත් විච්ජේදනය
- බාහිරින් විද්යුත් ශක්තිය සැපයීමෙන් ස්වයංසිද්ධ නොවන ප්රතික්රියාවක් සිදු කරවීම විද්යුත් විච්ජේදනය ලෙස සැළකිය හැක.
- ද්රාවණයකට විදුලිය යවා එහි ඇති ද්රව්ය තවදුරටත් සරල ද්රව්ය බවට පත් කිරීම විද්යුත් විච්ජේදනයේදී සිදුවේ.
උදා : විලීන NaCl විච්ජේදනය සලකමු.
\mathrm{කැතෝඩයේදී}\;:\;N{a^+}_{(aq)}\;+\;e\;\;\rightarrow\;\;Na_{(s)}
\mathrm{ඇනෝඩයේදී}\;:\;2C{l^-}_{(aq)}\;\;\rightarrow\;\;Cl_{2(g)}\;+\;2e
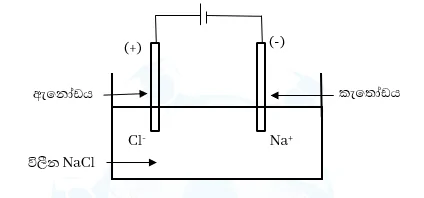
විද්යුත් විච්ජේදනයේදී :
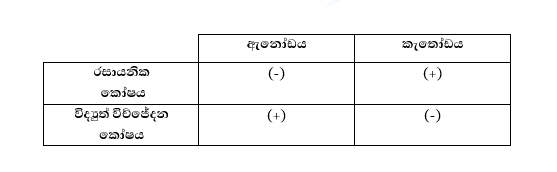
- කැතෝඩය : ද්රාවණයේ ඇති කැටායන ඔක්සිහරණය වෙමින් ඉවත්වන ඉලෙක්ට්රෝඩයයි. මෙහිදී කැතෝඩය සෘණ ධ්රැවය වේ.
- ඇනෝඩය : ද්රාවණයේ ඇති ඇනායන ඔ’කරණය වෙමින් ඉවත්වන ඉලෙක්ට්රෝඩයයි. මෙහිදී ඇනෝඩය ධන ධ්රැවය වේ.
විද්යුත් විච්ජේදනයේදී ප්රතිඵල නිර්ණය කිරීම
- කැතෝඩයේ ප්රතිඵල
- කැතෝඩයේදී ඔක්සිහරණය සිදුවේ.
- කැතෝඩයේදී නියත වශයෙන් කැටායනයක් විසර්ජනය වේ.
- කැටායන කිහිපයක් ඇතිවිට පළමුව විසර්ජනය වනුයේ විද්යුත් රසායනික ශ්රේණියේ පහළින් පිහිටන කැටායනය යි. (ශ්රේණියේ පහළ දී ඔක්සිහරණය පහසු නිසා)
- නමුත් විද්යුත් රසායනික ශ්රේණියේ ඉහලින් පිහිටන කැටායනයක සාන්ද්රණය වැඩිනම් පහළ කැටායනය මෙන්ම ඉහල කැටායනයද විසර්ජනය වේ.( මෙම ක්රමයට මිශ්රලෝහ සෑදිය හැක)
උදා : Zn2+ හා Cu2+ මිශ්රව ඇති ද්රාවණයක් විද්යුත් විච්ජේදනයේදී කැටායන දෙකම විසර්ජනය වී මිශ්ර ලෝහයක් වන පිත්තල සෑදේ. (Zn/Cu)
අමතර දැනුමට.
- අධිවෝල්ටීයතා සැපයුම (බලපෑම)
- ජලීය ද්රාවණයක H+ අයන සමග විද්යුත් රසායනික ශ්රේණියේ Na+, K+, Ca+, Ba2+… වැනි කැටායන ඇති විට පළමුව විසර්ජනය වනුයේ H+ අයන වේ.
- Pt, Pd, C වැනි නිෂ්ක්රීය ඉලෙක්ට්රෝඩ ඇති විට එය වඩා හොදින් සිදුවේ.
- Pb, Sn, Zn, Al, Hg වැනි ඉලෙක්ට්රෝඩ ඇතිවිට H+ අයන කාර්යක්ෂමව විසර්ජනය නොවේ. එහිදී අධික විභවයක් යෙදීමෙන් H+ අයන විසර්ජනය කල හැක. මෙය අධිවෝල්ටීයතා බලපෑම ලෙස හදුන්වයි.
- Pt, Pd ආදිය මතදී H+ අයන H2 බවට පත්වන ක්රියාව හොඳින් උත්ප්රේරණය වේ.
- ඇනෝඩයේ ප්රතිඵල
- ඇනෝඩයේදී ඔක්සිකරණය සිදුවේ.
- ඇනෝඩය සාදා ඇත්තේ ද්රාවණයේ කැටායනයකට හිමි ලෝහයකින් නම් ඇනෝඩයේදී ඇනායනයක් විසර්ජනය නොවන අතර ඇනෝඩය දියවීම සිදුවේ.
උදා : CuSO4 ද්රාවණයක් Cu ඉලෙක්ට්රෝඩ යොදා විද්යුත් විච්ජේදනයේදී ඇනෝඩය වන Cu ඉලෙක්ට්රෝඩය දියවීම.

- එසේ නොවන විට ඇනෝඩයේදී ඇනායනය විසර්ජනය වේ. ඇනායනය කීපයක් ඇතිවිට පළමුව විද්යුත් රසායනික ශ්රේණියේ ඉහලින් පිහිටන ඇනායනය විසර්ජනය වේ.(ශ්රේණියේ ඉහලදී ඔක්සිකරණය පහසු නිසා)
- ඇනායන වල ඔක්සිකරණය වීමේ හැකියාව, එහි විසර්ජනය වීමේ හැකියාව පහත පරිදි වේ.
SO42- < NO3– < F– < Cl– < Br– < I– < OH–
- නමුත් විද්යුත් රසායනික ශ්රේණියේ පහළින් පිහිටන ඇනායනයක සාන්ද්රණය වැඩිනම් ඉහල ඇනායනය විසර්ජනය නොවී පහළ ඇනායනය පළමුව විසර්ජනය වේ.
උදා : සා.NaCl විද්යුත් විච්ජේදනයේදී OH– විසර්ජනය නොවී Cl– Cl2 ලෙස පිටවීම.
- ඇනෝඩ ප්රතිඵල සඳහා අධිවෝල්ටීයතාවයේ විශේෂ බලපෑමක් නොමැත.
ෆැරඩේ නියතය(F)
- ඉලෙක්ට්රෝන 1mol සතු විදුලි ප්රමාණය ෆැරඩේ නියතය වේ. (ෆැරඩේ 1 කි)
- ඉලෙක්ට්රෝනයක් සතු විදුලි ප්රමාණය ඉලෙක්ට්රෝනයේ ආරෝපණයට සමාන වේ.
(e) ක ආරෝපණය. = 1.6021 x 10-19 C
(e) ක විදුලි ප්රමාණය = 1.6021 x 10-19 C
(e) 1mol විදුලි ප්රමාණය = 1.6021 x 10-19 C x 6.022 x1023 mol-1
= 96478 C mol-1
≃ 96490 C mol-1
≃ 96500 C mol-1

1 mol විදුලි ආරෝපණය = 96500 C mol-1 = 1F
Na+ 1 mol විදුලි ආරෝපණය = 1F
Mg2+ 1 mol විදුලි ආරෝපණය = 2F
Br– 1 mol විදුලි ආරෝපණය = 1F
SO4 (2-) 1 mol විදුලි ආරෝපණය = 2F
උදා :
- Ag+ අයන ප්රමාණයකට 1F විදුලි ප්රමාණයක් (e 1mol ) ගලාගිය විට කැතෝඩය මත Ag 1mol තැන්පත් වේ. (108g)
A{g^+}_{(aq)}\;+\;e\;\;\rightarrow\;\;Ag_{(s)\;\;}\;{(\mathrm{කැතෝඩයේදී})}
- Ag+ අයන ද්රාවණයකට 2F විදුලි ප්රමාණයක් ගලාගිය විට 216 g විසර්ජනය වේ.
- Cu2+ ද්රාවණයකට 2F විදුලි ප්රමාණයක් ගලා ගිය විට 63.5 g (1mol) විසර්ජනය වේ.
C{u^{2+}}_{(aq)}\;+\;2e\;\;\rightarrow\;Cu_{(s)}
4. Cu2+ ද්රාවණයකට 1F විදුලි ප්රමාණයක් ගලාගිය විට (63.5/2)g විසර්ජනය වේ.
- Cl– ද්රාවණයකට 2F විදුලි ප්රමාණයක් ගලාගිය විට Cl2 1 mol විසර්ජනය වේ.
රසායනික සමකය (E)

උදා :
\begin{array}{rcl}i.\;Ag\;(Ag^+)\;වල\;ර.ස.\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;&=&\;\frac{108}1\\ii.\;Zn\;(Zn^{2+})\;වල\;ර.ස.\;\;\;\;\;\;\;\;\;\;\;\;\;&=&\;\frac{65}2\;=\;32.5\\iii.\;Fe\;(Fe^{2+},\;Fe^{3+})\;වල\;ර.ස\;\;&=&\;\frac{56}2\;,\;\frac{56}3\end{array}
- මූලද්රව්යයකට සා.ප.ස්. එකක් පමණක් පවතින අතර රසායනික සමක කීපයක් පැවතිය හැක.
- Ag+ අයන ද්රාවණයකට 1F විදුලි ප්රමාණයක් ගලා ගියවිට රසායනික සමකයට 108g සමාන ස්කන්ධයක් විසර්ජනය වේ.
A{g^+}_{(aq)}\;+\;e\;\;\rightarrow\;\;Ag_{(s)\;\;}
- Zn2+ ද්රාවණයකට 1F විදුලි ප්රමාණයක් ගලාගියවිට රසායනික සමකයට 65/2 g සමාන ස්කන්ධයක් විසර්ජනය වේ.
Z{n^{2+}}_{(aq)}\;+\;2e\;\;\rightarrow\;Zn_{(s)}
- ද්රාවණයකට 1F විදුලි ප්රමාණයක් ගලාගිය විට රසායනික සමකයට සමානස්කන්ධයක් විසර්ජනය වේ.
විද්යුත් රසායනික සමකය (e)

උදා :
\begin{array}{rcl}1.Ag\;\mathrm{වල}\;\mathrm{වි}.\;\mathrm ර.\;\;\mathrm ස.\;\;\;\;\;\;\;\;\;\;&=&\;\frac{108}{96\;500}\\2.Fe3+\;\mathrm{වල}\;\mathrm{වි}.\;\mathrm ර.\;\mathrm ස.\;\;\;\;\;&=&\;\frac{\displaystyle\frac{56}3}{96\;500}\end{array}
ෆැරඩේ පළමු නියමය
- විද්යුත් විච්ජේදනයේදී විසර්ජනය වන මූලද්රව්ය වල ස්කන්ධය ද්රාවණයක් තුලින් ගලාගිය විදුලි ප්රමාණයට අනුලෝමව සමානුපාතික වේ.

උදා : AgNO3 ද්රාවණයක් තුල 4mA ධාරාවක් 45 min කාලයක් තුල ගලාගුය විට තැම්පත් වන ස්කන්ධය ගණනය කරන්න. (Ag=108)
A{g^+}_{(aq)}\;+\;e\;\;\rightarrow\;Ag_{(s)}
\begin{array}{rcl}m\;&=&\;eIt\\&=&\;\frac{\displaystyle\frac{108}1}{96\;500C}\;\times\;4\times10^{-3}A\;\times\;\left(45\times60s\right)\\&=&\;12mg\\&&\end{array}
ෆැරඩේ දෙවන නියමය
- එකම විදුලි ප්රමාණයක් වෙනස් ද්රාවණ තුලින් ගලාගිය විට විසර්ජනය වන ස්කන්ධය ඒවායේ රසායනික සමක වලට අනුලෝමව සමානුපාතික වේ.
- Zn2+ හා Ag+ ද්රාවණ තුලින් එකම විදුලි ප්රමාණයක් ගලාගිය විට
\begin{array}{l}m_{Zn}\;\alpha\;E_{Zn}\;\;--------(1)\\m_{Ag}\;\alpha\;E_{Ag}\;---------(2)\\\\\frac{(1)}{(2)}\;\;\;\frac{m_{Zn}}{m_{Ag}}\;\;=\;\frac{E_{Ag}}{E_{Zn}}\\\;\;\;\end{array}
උදා : AgNO3 සහ ZnSO4 තුලින් එකම විදුලියක් ගලායාමට සලස්වන ලදී. විසර්ජනය වූ Ag ස්කන්ධය 4.32 mg වේ නම් විසර්ජනය වන Zn ස්කන්ධය ගණනය කරන්න (Zn = 65 , Ag=108)
\begin{array}{rcl}\frac{m_{Zn}}{4.32mg}\;&=&\;\frac{\displaystyle\frac{65}2}{108}\\m_{Zn\;}\;&=&1.3mg\\&&\;\;\;\end{array}
අමතර දැනුම සදහා
විද්යුත් ලෝහාලේපනය
- විද්යුත් ලෝහාලේපනය යනු විද්යුතය භාවිතා කර එක් ලෝහයක් මත වෙනත් ලෝහ ස්ථරයක් ආලේප කිරීමයි.
- මෙය වඩා ක්රියාකාරී ලෝහයක් මත ක්රියාකාරීත්වයෙන් අඩු ලෝහයක් තැන්පත් වීමේ ක්රියාවට වඩා වෙනස් ක්රියාවකි.
- වටිනාකම ඉහළ නැංවීම අගය එකතු කිරීම , අලුත් ගුණ ඇති කිරීම , පවතින ගුණ ව්ඩාත් තීව්ර කිරීම, මළ බැදීමෙන් ආරක්ෂා කිර්රිම මෙම ක්රියාවලියේ අරමුණ වේ.
- විද්යුත් ලෝහාලේපනයේ ගුණාත්මක බවින් ඉහළ ආලේපනයක් සිදුවීම සඳහා ලෝහය සමඟ ආලේපිත ස්ථරය තදින් බැඳී පැවතිය යුතු වේ.
- ලෝහාලේපනයේදී සැලැකිය යුතු කරුණු වනුයේ
- ශක්තිමත් බව
- දිස්නය
- රසායනිකව නිෂ්ක්රීය වීම
- උසස් යාන්ත්රික ගුණ
- සිදුරු හා ඉරිතැලීම් නොමැතිවීම
- ඝනකමෙහි හා පෙනුමේ ඒකාකාරී බව
- ගුණාත්මක බවින් ඉහළ ස්ථරයක් ලබාගැනීමට පාලනය කළහැකි සාධක
- විද්යුත් විච්ඡේදනයේ ස්වභාවය සහ ගුණාත්මක බව
- උෂ්ණත්වය
- අගය
- විභව වෙනස ( බාහිර විභව අන්තරය)
- එකිනෙකට සාපේක්ෂව ඇනෝඩ සහ කැතෝඩ ස්ථානගත කිරීම
- භාණ්ඩයේ පිරිසිදු බව සහ එහි පෘෂ්ඨයේ ස්වභාවය
- අයණ සාණ්ද්රණය
- ධාරා ඝණත්වය
- ද්රාවනයේ පවතින අනෙකුත් අයණවල ස්වභාවය
- ඇනෝඩයේ සංශුද්ධතාව
- ඉලෙක්ට්රෝඩවලදී ප්රතික්රියා දෙකක් හෝ වැඩි ගණනක් සමගාමීව සිදුවිය හැක.
- විද්යුත් ලොහාලේපන ඇටවුමක්, විද්යුත් විච්ඡේදන ඇටවුමක ස්වරූපයන්ට යුක්ත වන අතර , ලෝහ ස්ථරය ආලේප කර ගැනීමට නියමිත වස්තුව ඇටවුමෙහි (-) අග්රයට සම්බන්ධිත කැතෝඩය ලෙස පවත්වා ගනී.
- උෂ්ණත්වය, සාන්ද්රණය, වෝල්ටීයතාව, ඉලෙක්ට්රෝඩවල ස්වභාවය වෙනස් කිරීමෙන් ඒවා පාලනය කළහැක.
ලෝහ විඛාදනය
- විඛාදනය යනු ලෝහයක් එය පිහිටි පරිසරය සමඟ සිදුවන රසායනික හෝ විද්යුත් රසායනික ක්රියා නිසා ක්ෂය වීමයි.
- ලෝහ විඛාදනය විද්යුත් රසායනික ක්රියාවලියකි.
විඛාදනය වලක්වන ක්රම
- කැතෝඩීය ආරක්ෂණය
- කැතෝඩීය ආරක්ෂණයේදී සලකනු ලබන ලෝහය කැතෝඩය බවට පත්කරයි.
- එවිට එම ලෝහය සමඟ සම්බන්ධ කරන අනෙක් ලෝහය ඇනෝඩය ලෙස ක්රියා කරයි.
- මේ සඳහා ලෝහයට වඩා විද්යුත් රසායනික ශ්රේණියේ ඉහළින් පිහිටන ලෝහයක් සමඟ ලෝහය සම්බන්ධ කර තබනු ලැබේ.
- උදා :- වානේ ජලනල, ඉන්දන නල, ගබඩා ටැංකි, ජැටිවල ඇති වානේ කඳන් යනාදිය Mg වැනි ලෝහ සමඟ සම්බන්ධ කර තැබීම. (මෙහිදී යකඩ කැතෝඩය ලෙස ක්රියා කර විඛාදනයෙන් ආරක්ෂා වන අතර Mg ඇනෝඩය ලෙස ක්රියා කර විඛාදනය වේ.)
- ඇනෝඩීය ආරක්ෂණය
- ඇනෝඩීය ආරක්ෂණයේදී සලකනු ලබන ලෝහය ඇනෝඩය ලෙස ක්රියාකරයි.
- එවිට එම ලෝහය සමඟ සම්බන්ධ කරන අනෙක් ලෝහය කැතෝඩය ලෙස ක්රියා කරයි.
- එවිට ආරක්ෂා කළයුතු ලෝහය මත කැතෝඩය ලෙස ක්රියාකරන ලෝහයේ ආලේපනයක් යොදයි.
- වායුගෝලීය සංඝටක නිසා විඛාදනයවීම වළකී.
- උදා:- යකඩ මත Sn ආලේපනය කිරීම.
අකර්මන්ය කිරීම
- මෙහිදී ලෝහය මත එය තව දුරටත් විඛාදනය වැලැක්වෙන පරිදි දැඩි අක්රීය පෘෂ්ඨීය තලයක් ස්වයංසිද්ධ ලෙස සැදීමට සලසනු ලැබේ.
- සාමන්යයෙන් මෙම පටලය (අණූ) කීපයක ඝනකමින් යුත් ඔක්සයිඩ හෝ නයිට්රයිඩ පටලයකි.
උදා:- 1. මල නොකන වානේ අකර්මන්ය කිරීමට HNO3 අම්ලය යොදා ගැනීම.එහිදී යකඩ මත ඔක්සයිඩ පටලයක් ඇති වේ.
2. F2 ආශ්රිත කටයුතු සඳහා Ni ලෝහය යොදා ගැනීම.මෙහිදී සෑදෙන NiF2 පටලය නිසා ලෝහය අකර්මන්ය වේ.
- ද්වීලෝහ විඛාදනයේදී වඩා ප්රතික්රියාශීලී ලෝහය (විද්යුත් රසානයනික ශ්රේණියේ ඉහළින් පිහිටි ලෝහය) වේගයෙන් විඛාදනය වේ.
- වැඩිම හානිය සිදුවන්නේ ලෝහ යුගල ගැටෙන සන්ධියක වේ. (සන්ධියෙන් ඈතට යත්ම විඛාදනය වීමේ සීඝ්රතාව අඩුවේ. )

