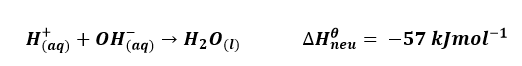සම්මත එන්තැල්පි විපර්යාස හැඳින්වීම
සම්මත උත්පාදන එන්තැල්පිය (ΔH⁰f ) (Standard enthalpy of formation)
- සම්මත අවස්ථාවේ ඇති යම් ද්රව්යයක මවුලයක් , සම්මත අවස්ථාවේ සමුද්දේශ ස්වරූපයෙන් ඇති සංඝටිත මුලද්රව්ය වලින් උත්පාදනය වීමේ දී සිදුවන එන්තැල්පි විපර්යාසය, සම්මත උත්පාදන එන්තැල්පිය නම් වේ.
උදා:-
\begin{array}{c}{\mathrm H}_{(\mathrm g)}+\frac12{\mathrm O}_{(\mathrm g)}\rightarrow{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\;\;\;\;\triangle{\mathrm H^{\mathrm\theta}}_{\mathrm f}=-285.8\mathrm{kJmol}^{-1}\\{\mathrm H}_{2(\mathrm g)}+\frac12{\mathrm O}_{(\mathrm g)}\rightarrow{\mathrm H}_2{\mathrm O}_{(\mathrm g)\;}\;\;\;\triangle{\mathrm H^{\mathrm\theta}}_{\mathrm f}=-241.8\mathrm{kJmol}^{-1}\end{array}
මූලද්රව්ය සමුද්දේශ ස්වරූපයෙන් එනම් සම්මත පීඩනය 1atm උෂ්ණත්වය 298.15K(25⁰C) විට වඩාත්ම ස්ථායි අවස්ථාවේ සංශුද්ධ මූලද්රව්යයක සම්මත එන්තැල්පිය ශුන්ය (0) වේ.
උදා : 298.15K දී වඩාත්ම ස්ථායි ආකාර
සම්මත දහන එන්තැල්පිය (ΔH ⁰c ) (Standard enthalpy of combusion)
- සම්මත තත්ත්ව යටතේ දී මුලද්රව්යයක හෝ සංයෝගයක මවුල එකක් වැඩිපුර O2 සම්පූර්ණයෙන්ම ප්රතික්රියා කරලීම හා සම්බන්ධ එන්තැල්පිය සම්මත දහන එන්තැල්පිය ලෙසට සැලකේ.
\begin{array}{c}{\mathrm C}_6{\mathrm H}_{6(\mathrm g)}+\frac{15}2{\mathrm O}_{2(\mathrm g)}\rightarrow6{\mathrm{CO}}_{2(\mathrm g)}+3{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\;\;\;\;\;\;\;\triangle{\mathrm H}_{\mathrm C}{}^{\mathrm\theta}=-6534.8\mathrm{kJ}\end{array}
සම්මත බන්ධන විඝටන එන්තැල්පිය (ΔH ⁰D ) (Standard enthalpy of bond dissociation)
- සම්මත තත්වවලදී බන්ධන මවුලයක් විඝටනය කර සම්මත අවස්ථාවේ ඇති වායුමය මූලද්රව්ය හෝ සංයෝග බවට විඝටනය වීමේ දී සිදු වන එන්තැල්පි විපර්යාසයයි.
CH4(g) → CH3(g) + H(g)
H2(g) → 2H(g)
\begin{array}{c}{\mathrm{CH}}_{4(\mathrm g)}\rightarrow{\mathrm{CH}}_{3(\mathrm g)}+{\mathrm H}_{(\mathrm g)}\;\;\;\;\;\;\;\;\;\triangle\mathrm H_{\mathrm D}^{\mathrm\theta}=428\mathrm{kJmol}^{-1}\\{\mathrm{CH}}_{3(\mathrm g)}\rightarrow{\mathrm{CH}}_{2(\mathrm g)}+{\mathrm H}_{(\mathrm g)}\;\;\;\;\;\;\;\;\;\;\triangle\mathrm H_{\mathrm D}^{\mathrm\theta}=441\mathrm{kJmol}^{-1}\\{\mathrm{CH}}_{2(\mathrm g)}\rightarrow{\mathrm{CH}}_{(\mathrm g)}+{\mathrm H}_{(\mathrm g)}\;\;\;\;\;\;\;\;\;\;\;\triangle\mathrm H_{\mathrm D}^{\mathrm\theta}=454\mathrm{kJmol}^{-1}\\\;{\mathrm{CH}}_{(\mathrm g)}\rightarrow{\mathrm C}_{(\mathrm g)}+{\mathrm H}_{(\mathrm g)}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\triangle{\mathrm H}_{\mathrm D}{}^{\mathrm\theta}=344\mathrm{kJmol}^{-1}\end{array}
එම නිසා මෙතේන් වල බන්ධන විඝටන ශක්ති වෙනස යනු ඉහත අගයන් හතරෙහි මධ්යන්යය අගය වේ.
CH4(g) හි මධ්යන්ය සම්මත බන්ධන විඝටන = (428 + 441 + 454 + 344 ) / 4
එන්තැල්පි විපර්යාසය = 416.75
සම්මත උදාසීනකරණ එන්තැල්පිය (ΔH ⁰neu ) (Standard enthalpy of bond neutralization)
- සම්මත අවස්ථාවේ ඇති ජලීය H+ අයන මවුලයක් හා ජලීය OH–අයන මවුලයක් ප්රතික්රියා වී ජලය මවුලයක් සෑදීම ආශ්රිත එන්තැල්පි විපර්යාසයයි.
සම්මත සජලන එන්තැල්පිය (ΔH ⁰hyd ) (Standard hydration enthalpy of hydration)
- සම්මත අවස්ථාවේ ඇති වායුමය අයන මවුලයක් අතිරික්ත ජල ප්රමාණයක ද්රාවණය වී 1.0 moldm-1 ද්රාවණ තත්ත්වයට පත් වීම ආශ්රිත එන්තැල්පි විපර්යාසයයි.
{\mathrm{Na}^+}_{(\mathrm g)}+\mathrm{Water}\rightarrow{\mathrm{Na}^+}_{(\mathrm{aq})}\;\;\;\;\;\;\;\;\triangle{\mathrm H^{\mathrm\theta}}_{\mathrm{hyd}}=-406\mathrm{kJmol}^{-1}
සම්මත ද්රාවණ එන්තැල්පිය (ΔH ⁰dis ) (Standard enthalpy of dissolution)
- සම්මත අවස්ථාවේ ඇති ද්රාවණයක මවුලයක් ද්රාවක ප්රමාණයක ද්රාවණය වී 1.0 moldm-1 ද්රාවණයක් සෑදීමේ දී සිදුවන එන්තැල්පි විපර්යාසයයි.
\;{\mathrm{NaCl}}_{(\mathrm g)}+\mathrm{Water}\rightarrow{\mathrm{NaCl}}_{(\mathrm{aq})}\;\;\;\;\;\triangle\mathrm H=1\mathrm{kJmol}^{-1}
සම්මත සද්රාවණ එන්තැල්පිය (ΔH ⁰sol ) (Standard enthalpy of solvation)
- සම්මත අවස්ථාවේ ඇති වායුමය අයන මවුලයක් අතිරික්ත ද්රාවණ ප්රමාණයක් හමුවේ 1.0 moldm-1 පරිපූර්ණ ද්රාණයක් සෑදීමේදී සිදුවන එන්තැල්පි විපර්යාසයයි.
\;\;\;\;{\mathrm{Mn}^{\mathrm n+}}_{(\mathrm g)}\;+\;\mathrm{solvent}\;\rightarrow\;\;{\mathrm{Mn}^{\mathrm n+}}_{(\mathrm{solvent})}
- එන්තැල්පි සටහනක් සඳහා සරල නිදසුනක් සලකා බලමු.
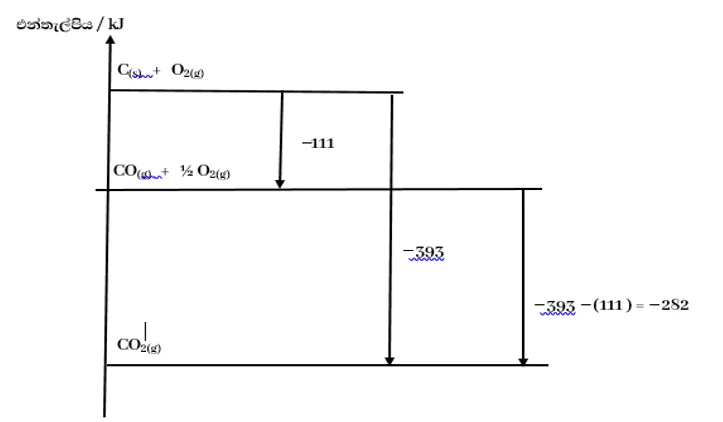
නිදසුන : කාබන්වල සම්මත දහන එන්තැල්පිය -393 kJmol-1 වන අතර කාබන්මොනොක්සයිඩ්වල සම්මත උත්පාදන එන්තැල්පිය -111 kJmol-1 වේ. CO(g)+ 1/2O2(g) → CO2(g) යන විපර්යාසය සඳහා සම්මත එන්තැල්පි වෙනස එන්තැල්පි සටහනක් මඟින් ගණනය කරන්න.
හෙස් නියමය
- කිසියම් ක්රියාවලියක් පියවර එකක් හෝ කීපයක් වශයෙන් සිදු වේ නම් සමස්ත ක්රියාවලිය සඳහා එන්තැල්පි විපර්යාසය ඒ ඒ පියවරයන්හි එන්තැල්පි විපර්යාස වල එකතුවට සමාන වේ.
- එනම් එය සිදුවන මාර්ගයෙන් ස්වායක්තය.
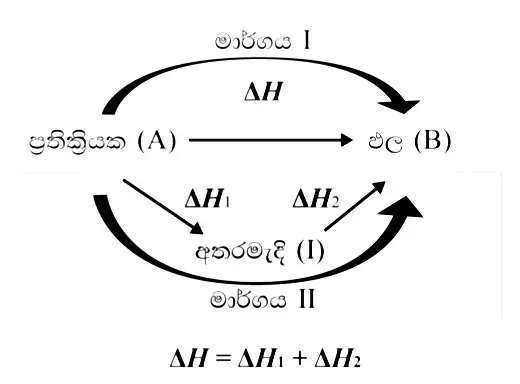
හෙස් නියමය සරල නිදසුනක් මඟින් තවදුරටත් අධ්යනය කරමු…
නිදසුුන
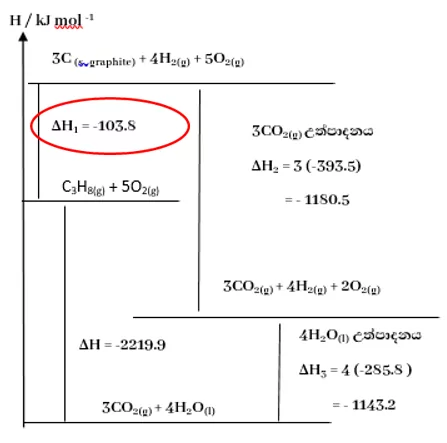
අපිට පහත දැක්වෙන ප්රතික්රියාවේ සම්මත එන්තැල්පි විපර්යාසය සෙවීමට අවශ්යව ඇතැයි සිතමු.
3{\mathrm C}_{(\mathrm s)}\;+\;4{\mathrm H}_{2(\mathrm g)}\;\rightarrow{\mathrm C}_3{\mathrm H}_{8(\mathrm g)}\;;\;\triangle\mathrm H^{\mathrm\theta}=?
- මෙම ගණනය මූලික ක්රම 03 ක් භාවිතා කරමින් විසඳිය හැකිය.
මෙහිදී මවුල එකක් සඳහා දහන ප්රතික්රියා සැලකීමෙන්,
\begin{array}{l}{\mathrm C}_3{\mathrm H}_{8(\mathrm g)}+5{\mathrm O}_{2(\mathrm g)}\rightarrow3{\mathrm{CO}}_{2(\mathrm g)}\;+\;4{\mathrm H}_2{\mathrm O}_{(\mathrm I)}\;;\;\triangle\mathrm H^{\mathrm\theta}=-2219.9\mathrm{kJmol}^{-1}\\{\mathrm C}_{(\mathrm s)}+{\mathrm O}_{2(\mathrm g)}\rightarrow{{\mathrm{CO}}_2}_{(\mathrm g)}\;;\;\triangle\mathrm H^{\mathrm\theta}=-393.5\mathrm{kJmol}^{-1}\\\frac12{{\mathrm O}_2}_{(\mathrm g)}+{\mathrm H}_{2(\mathrm g)}\rightarrow{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;;\;\triangle\mathrm H^{\mathrm\theta}=-285.8\mathrm{kJmol}^{-1}\end{array}-
- රසායනික සමීකරණ සංයෝජනය මඟින් විසඳීම
(a) හි ආපසු ප්රතික්රියාව C3H5(g) හි උත්පාදනය වේ. එබැවින් අපට මෙසේ ලිවිය හැක.
3{\mathrm{CO}}_{2(\mathrm g)}\;+\;4{\mathrm H}_2{\mathrm O}_{(\mathrm I)}\;\rightarrow\;{\mathrm C}_3{\mathrm H}_{8(\mathrm g)}+5{\mathrm O}_{2(\mathrm g)}\;;\;\;\triangle\mathrm H^{\mathrm\theta}=-2219.9\mathrm{kJmol}^{-1}\;\;\;\;\;\;\;\;\;\;(\mathrm a')
ඉලක්කගත ප්රතික්රියාවේ ප්රතික්රියක (C) හා (H2) වේ. මේ එක එකෙන් අදාල මවුල ප්රමාණ ඇතුළත්වීම සඳහා (b) සමීකරණය තුනෙන් ද (c) සමීකරණය හතරෙන්ද ගුණ කළ කළ යුතුය.
\begin{array}{l}3{\mathrm C}_{(\mathrm s)}+3{\mathrm O}_{2(\mathrm g)}\rightarrow3{{\mathrm{CO}}_2}_{(\mathrm g)}\;;\;\triangle\mathrm H^{\mathrm\theta}=3(-393.5\mathrm{kJmol}^{-1}\;)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;(\mathrm b')\\2{{\mathrm O}_2}_{(\mathrm g)}+2{\mathrm H}_{2(\mathrm g)}\rightarrow2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;;\;\triangle\mathrm H^{\mathrm\theta}=2(-285.8\mathrm{kJmol}^{-1})\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;(\mathrm c')\end{array}
මෙහිදී C(s) මවුල තුනක් මවුල තුනක් හා H2(g) මවුල හතරක් වැයවී ඇති අතර C3H8(g) මවුල එකක් සෑදී ඇත. මේ අපට අවශ්ය වූ ප්රතික්රියාවයි. දැන් අපිට ප්රතිසංවිධානය කරන ලද සමීකරණ 3 එකතු කිරීමෙන් (a’) + (b’) + (c’) අවශ්ය සංයෝජනය ලබාගත හැක.
\begin{array}{l}\underline{\begin{array}{l}\cancel{3{\mathrm{CO}}_{2(\mathrm g)}}\;+\;\cancel{4{\mathrm H}_2{\mathrm O}_{(\mathrm I)}}\;\rightarrow{\mathrm C}_3{\mathrm H}_{8(\mathrm g)}+\cancel{5{\mathrm O}_{2(\mathrm g)}}\;;\;\triangle\mathrm H^{\mathrm\theta}=2219.9\mathrm{kJmol}^{-1}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;(\mathrm a')\\3{\mathrm C}_{(\mathrm s)}+\cancel{3{\mathrm O}_{2(\mathrm g)}}\rightarrow\cancel{3{{\mathrm{CO}}_2}_{(\mathrm g)}\;};\;\triangle\mathrm H^{\mathrm\theta}=3(-393.5\mathrm{kJmol}^{-1})\;=\;-1180.5\;\mathrm{kJmol}^{-1}\;\;\;\;\;\;\;\;\;(\mathrm b')\\\cancel{2{{\mathrm O}_2}_{(\mathrm g)}}+4{\mathrm H}_{2(\mathrm g)}\rightarrow4{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;;\;\triangle\mathrm H^{\mathrm\theta}=4(-285.8\mathrm{kJmol}^{-1})\;=-1143.2\;\mathrm{kJmol}^{-1}\;\;\;\;\;\;\;\;\;(\mathrm c')\end{array}}\\3{\mathrm C}_{(\mathrm s)}\;+\;4{\mathrm H}_{2(\mathrm g)}\;\rightarrow{\mathrm C}_3{\mathrm H}_{8(\mathrm g)}\;;\;\triangle\mathrm H^{\mathrm\theta}=-103.8\mathrm{kJmol}^{-1}\end{array}
-
- තාප රසායනික චක්රයක් මඟින් විසඳීම
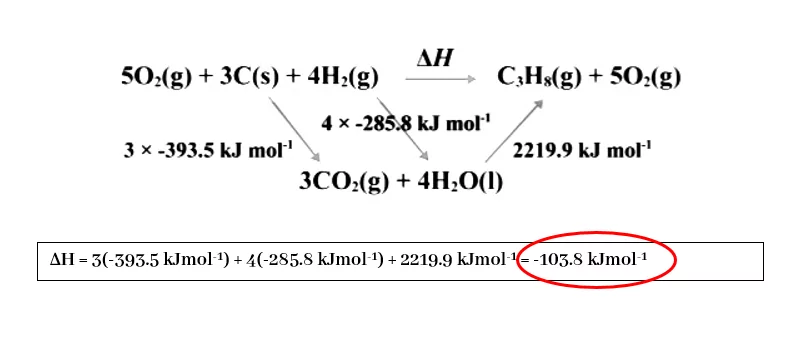
-
- එන්තැල්පි රූපසටහනක් මඟින් විසඳීම