ඉලෙක්ට්රෝන පිරීමෙ රටාවට අදාල මූලධර්ම සහ නීති
1.පවුලි බහිෂ්කාර මූලධර්මය
මින් පැහැදිලි කරනුයේ යම් කාක්ෂිකයක උපරිම ඉලෙක්ට්රෝන 2කට වඩා පැවතිය නොහැකි බවයි. තවද ඒවා ශක්තිය වැඩිවන පිලිවලට කාක්ෂිකයට ඉලෙක්ට්රෝන පිරීම සිදු වේ.
පරමාණුවක යම් ඉලෙක්ට්රෝනයක් සදහා වන ක්වොන්ටම් අංක කුලකය එයටම අන්යය වන බවත් ඉලෙක්ට්රෝන දෙකකට එකම ක්වොන්ටම් අංකය පැවතිය නොහැකි බවත් තවදුරටත් මෙයින් පැහැදිලි කෙරේ.
2.හූන්ඩ්ස් නියමය
කිසියම් උපශක්ති මට්ටමක වන විභේදනය වූ කාක්ෂික වලට ඉලෙක්ට්රෝන පිරීමේදි පලමුව සමාන්තර එකම දිශාවට තනි තනිව පිරී පසුව ප්රතිවිරුද්ධ දිශාවට ඉලෙක්ට්රෝන යුගල් වීම සිදු වන බව මෙයින් පැහැදිලි කෙරේ.
කාක්ෂිකයක වන ඉලෙක්ට්රෝන අර්ධ ඊ හිසකින් සමන්විත ඊතලයක් මගින් නිරූපණය කරනු ලැබේ.කාක්ෂිකය තුල ඉලෙක්ට්රෝන 2ම පවතියි නම් ඒවා යුගලනය වූ ඉලෙක්ට්රෝන ලෙසත් 1 බැගින් පවතියි නම් ඒවා වියුග්ම ඉලෙක්ට්රෝන ලෙසත් සැලකේ.

s කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේ රටා,
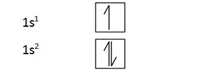
p කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේ රටා,
p1 < p2 < p3 < p4 < p5 < p6
ස්ථායිතාව වැඩි වේ
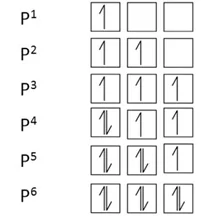
- np3 අර්ධ පිරීම වඩා np6 පූර්ණ පිරීම ස්තාථායිතාවයෙන් වැඩිය.
- np3 අර්ධ පිරීමට වඩා np5 පිරීම ස්ථායිතාවයෙන් අඩුය.
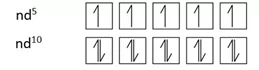
d කාක්ෂික ඉලෙක්ට්රෝන පිරීමෙ රටා,
d කාක්ෂික වල ඉලෙක්ට්රෝන පිරීමේදී nd5 nd10 විශේෂ ස්ථායිතාවයක් පෙන්වයි.
3.අවුෆ්බාවූ මූලධර්මය ( ගොඩනැංවීමේ මූලධර්මය )
එක් එක් ප්රධාන ශක්තිමට්ටම් තුල උපශක්ති මට්ටම්වල අන්තර්ගත වූ කාක්ෂික වලට ඉලෙක්ට්රෝන පිරෙනුයේ ශක්තිය ක්රමානූකූල ලෙස වැඩිවන අනුපිළිවෙලට බව සොයාගෙන ඇත. එහිදී උපශක්ති මට්ටම්වල ශක්තිය වැඩිවන අනුපිළිවෙල සොයා ගැනීමට භාවිතා වන සිද්ධාන්තය අවුන්ෆ්බාවූ මූලධර්මය වේ.
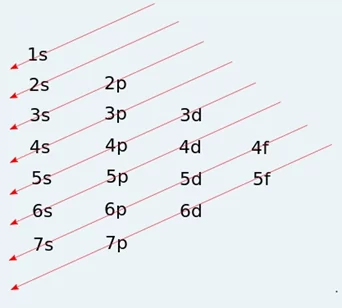
- ඒ අනුව ශක්තිය වැඩිවන අනුපිළිවෙලට උපශක්ති මට්ටම් වලට ඉලෙක්ට්රෝන පිරීමේ අනුපිළිවෙල පහත පරිදි වේ.
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
ඉලෙක්ට්රෝන වින්යාසය
ඉලෙක්ට්රෝන වින්යාසය යනුවෙන් අදහස් වන්නේ පරමාණුවක හෝ අයනයක ඉලෙක්ට්රෝන න්යෂ්ටිය වටා ව්යාප්ත වී ඇති අකාරයයි. මෙහිදී ප්රධාන ශක්ති මට්ටම් ,උපශක්ති මට්ටම් හා කාක්ෂික යන ව්යාප්ති ඒකක තුන තුළ ඉලෙක්ට්රෝන ව්යාප්තිය සලකා බැලේ.මූලද්රව්ය වල ඉලෙක්ට්රෝන වින්යාස ලියා දැක්වීම පහත ආකාර වේ.
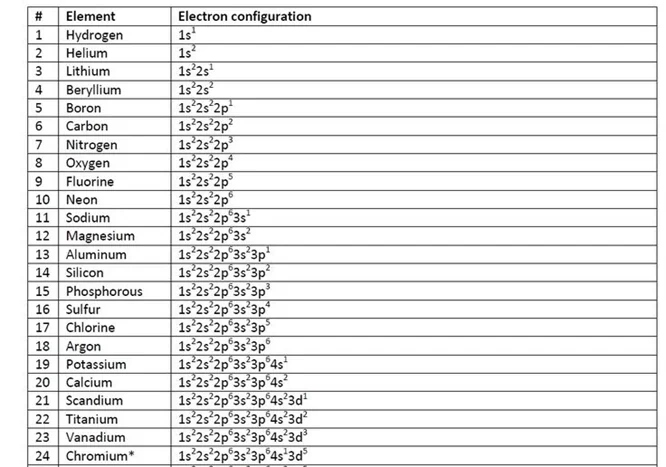
- 3d4 පිරීමට වඩා 3d5 පිරීම ස්ථායීතාවයෙන් වැඩි බැවින් 4s වලින් වලින් ඉලෙක්ට්රෝනයක් 3d වෙතට සංක්රමණය වෙමින් 4s13d5 ස්ථායි වින්යාසය ලබා ගනියි.
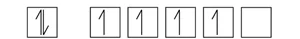
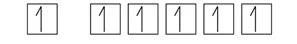
- මෙසේ වීමට නම් අදාල ශක්ති මට්ටම් එකිනෙක ආසන්නයේ තිබිය යුතු අතර ඉලෙක්ට්රෝන සංක්රමණය අදාල ශක්තිය අඩු අගයක් විය යුතුය.පහත රූපයෙ දැක්වෙන්නෙ උපශක්ති මට්ටම් වල විභව ශක්ති වැඩි වීමෙ පිලිවලයි.
- පරමාණුක ක්රමාංකය 25 සිට 40 දක්වා මූලද්රව්ය වල ඉලෙක්ට්රෝන වින්යාස පහත පරිදි වේ

- පරමාණුක ක්රමාංකය 41ට වැඩි ඇතැම් මූලද්රව්ය අවුෆ්බාවූ නියමය නොසලකා හරිමින් ස්ථායි වින්යාස ද නොසලකා හරිමින් සංකීර්ණ ආකාරයට පිරේ.
උදා : 41, 43, 44, 45, 46
උපශක්ති මට්ටම්වල ඉලෙක්ට්රෝන සංකේත කිරීම
3d6
3 → ප්රධාන ශක්ති මට්ටම
d → උපශක්ති මට්ටම
6 → එහි වූ ඉලෙක්ට්රෝන ගණන
- 3 වන ප්රධාන ශක්ති මට්ටමේ d උප මට්ටමේ ඉලෙක්ට්රෝන 6ක් ඇති බව මින් අදහස් කෙරේ.
උදා : යකඩ වල පරමාණුක ක්රමාංකය 26කි. එහි ඉලෙක්ට්රෝන වින්යාසය ලියා සංයූජතා කවචයේ ඉලෙක්ට්රෝන නිරූපණය කර වියුග්ම ඉලෙක්ට්රෝන ගණන සොයන්න.
- ඉලෙක්ට්රෝන වින්යාසය = 1s2 2s22p6 3s23p63d10 4s2
- පරමාණුක ක්රමාංකය = 26
අවසාන ශක්ති මට්ටම = 4s2
- වියුග්ම ඉලෙක්ට්රෝන = 4
කැටායන වල ඉලෙක්ට්රෝන වින්යාස ලිවීම.
- පරමාණුවක අවසාන ශක්ති මට්ටමේ වූ උපශක්ති මට්ටමෙන් ඉලෙක්ට්රෝන ඉවත් කර අනුරූප කැටායන සාදයි.
උදා :

- මින් ජලීය ද්රාවණ වලදී වඩා ස්ථායි වනුයේ Cu2+ වේ. ජලීය ද්රාවණයේදී ස්ථායීතාව කෙරෙහි සජලන එන්තැල්පිය බලපායි. අරය අඩු වී ආරෝපණය වැඩි වන විට මෙය වැඩි වේ.
- ඉලෙක්ට්රෝන පිරීමෙ ස්ථායිතාව මත අයන වල ස්ථායිතාව කතා කරනුයේ වායුමය අවස්තාවේදී පමණි.
උද : පරමාණුක ක්රමාංකය 47 වන x නම් මූලද්රව්යයේ අවසාන උපශක්ති මට්ටමේ ඉලෙක්ට්රෝන වින්යාසය ලියා දක්වන්න.

ඇනායන වල ඉලෙක්ට්රෝන වින්යාසය ලිවීම
පරමාණුවක අවසාන උපශක්ති මට්ටම පිරෙන තෙක් ඉලෙක්ට්රෝන ලබාගෙන ඍණ අයන සාදයි. මේ අනුව H , He වින්යාසය ලබා ගන්නා අතර අනෙක් සෑම අයනයක්ම ns2 np6 නිෂ්ක්රිය වායු වින්යාසය ලබා ගනියි. එබැවින් H– හැර අනෙක් ඇනායන වල H– හැර බාහිර උපශක්ති මට්ටමේ ඉලෙක්ට්රෝන 6ක් ඇත.
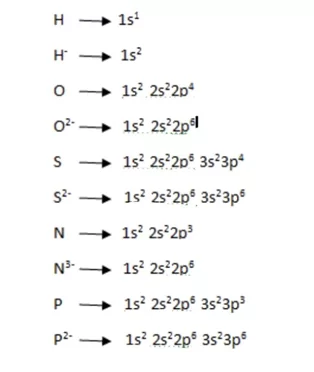
උදා : x හා y නම් මූලද්රව්ය 02ක් x2- , y3– නම් ඇනායන සාදයි.මෙම ඇනායන වල බාහිර උපශක්ති මට්ටමෙ ඉලෙක්ට්රෝන nx හා ny ආකාර වේ නම් සත්ය වනුයේ,
i)nx = ny = 8 ii) nx = ny = 8 iii) nx = ny = 6 iv) nx = ny = 6
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



