පරමාණුක ස්කන්ධ ඒකකය
- ¹²C සමස්ථානික C පරමාණුවක ස්කන්ධයෙන් 1/12ක් පරමාණුක ස්කන්ධ ඒකකයක් ලෙස හැඳින්වේ.
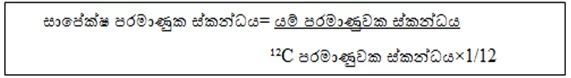
පරමාණුක ස්කන්ධ ඒකකය = ¹²C පරමාණුවක ස්කන්ධය × 1/12
- මෙම ඒකකයට සාපේක්ෂව අනෙකුත් පරමාණුවල සහ අණුවල ස්කන්ධ මිනුම් කෙරේ.
සාපේක්ෂ පරමාණුක ස්කන්ධය
- ඩෝල්ටන්ගේ පරමාණුක වාදය ට අනුව පරමාණු යනු ඉතා කුඩා ස්කන්ධයක් සහිත අංශු විශේෂයකි. මේවායේ ස්කන්ධ kg වලින් ගත් විට ඉතා කුඩා අගයන් ලැබේ.
උදා: H = 1.66×10-27 kg O = 2.66×10-26 kg
C = 1.99×10-26 kg Ag = 1.79×10-25 kg
- එම නිසා මෙම ස්කන්ධයන් පහසුවෙන් ප්රකාශ කිරීම සඳහා වෙනත් පරිමාණයක් අවශ්ය වේ. මෙහිදී යොදාගන්නා පරිමාණය පරමාණුක ස්කන්ධ ඒකකයයි.
- එනම් යම් පරමාණුවක ස්කන්ධය ¹²C පරමාණුවක ස්කන්ධයෙන් 1/12කට සාපේක්ෂව මිනුම් කළ විට ලැබෙන අගය එහි සාපේක්ෂ පරමාණුක ස්කන්ධයයි.
උදා:01) Ca පරමාණුවක ස්කන්ධය 6.64×10-26 kg වේ. Ca වල සාපේක්ෂ පරමාණුක ස්කන්ධය ගණනය කරන්න.

02) X නැමැති පරමාණුවක ස්කන්ධය 12C පරමාණුවක ස්කන්ධය මෙන් 6 ගුණයක් වේ නම් X වල සාපේක්ෂ පරමාණුක ස්කන්ධය ගණනය කරන්න.

03)Mg වල සා.ප.ස්. 24ක් වේ. 12C පරමාණුවක ස්කන්ධය 1.99×10-23 g වේ නම් Mg පරමාණුවක ස්කන්ධය ගණනය කරන්න.
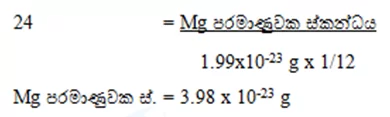
සාපේක්ෂ අණුක ස්කන්ධය
- පරමාණු මෙන්ම අණු ද ඉතා කුඩා අංශු විශේෂයකි. එම නිසා ඒවායේ ස්කන්ධ මිනුම් කිරීම සඳහා ද පරමාණුක ස්කන්ධ ඒකකය භාවිතා කෙරේ.
- යම් අණුවක ස්කන්ධය 12C පරමාණුවක ස්කන්ධයෙන් 1/12කට සාපේක්ෂව මිනුම් කළ විට ලැබෙන අගය සාපේක්ෂ අණුක ස්කන්ධය යි.
උදා:01) H2O අණුවක ස්කන්ධය 2.98×10-26 kg වේ නම් H2O වල සාපේක්ෂ අණුක ස්කන්ධය ගණනය කරන්න.

02) X නමැති අණුවක ස්කන්ධය 12C පරමාණුවක ස්කන්ධය මෙන් 3.33 ගුණයක් වේ. X වල සාපේක්ෂ අණුක ස්කන්ධය ගණනය කරන්න.
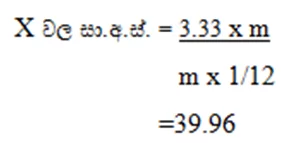
ඇවගාඩ්රෝ නියතය (L or NA)
පහත ප්රකාශ සලකන්න.
- කිසියම් මුලද්රව්යයක සාපේක්ෂ පරමාණුක ස්කන්ධයේ සංඛ්යාත්මක අගයට සමාන ප්රමාණයක් ගත්විට එහි පරමාණු 6.022 x 1023 සංඛ්යාවක් ඇත.
උදා: 12C සමස්ථානිකයේ සා.ප.ස්. 12ක් වේ. එම නිසා මෙහි 12g ක C පරමාණු 6.022 x 1023 සංඛ්යාවක් ඇත.
- කිසියම් සංයෝගයක සාපේක්ෂ අණුක ස්කන්ධය සංඛ්යාත්මක අගයට සමාන g ප්රමාණයක් ගත් විට එහි අණු 6.022 x 1023 සංඛ්යාවක් ඇත.
උදා: H2O වල සා.අ.ස්. 18ක් වේ. එම නිසා H2O 18g ක් තුල ජල අණු 6.022 x 1023 සංඛ්යාවක් ඇත.
- සම්මත උෂ්ණත්වයේදී සහ පීඩනයේ දී වායුවක 22.4 dcm3 පරිමාවක් තුල අණු 6.022 x 1023 සංඛ්යාවක් ඇත.(පරිපූර්ණ හැසුරුම උපකල්පනය කළ විට )
උදා; ස.උ.පී. හිදී O2 වායුවේ 22.4 dcm3 ක් තුළ O2 අණු 6.022 x 1023 සංඛ්යාවක් ඇත.
- 96500 C ක ආරෝපණ ප්රමාණයක් තුළ ආරෝපණ ඒකක (ධන හෝ ඍණ) 6.022 x 1023 සංඛ්යාවක් ඇත.
- ඉහත සෑම අවස්ථාවක දී ම එක්තරා නියත අගයක් ලෑබී ඇත. එය ඇවගාඩ්රෝ නියතය යි.
අර්ථ දැක්වීම
- 12C සමස්ථානිකයේ හරියටම 12.00 g ක් තුළ අන්තර්ගත පරමාණු සංඛ්යාව ඇවගාඩ්රෝ නියතය ලෙස හැදින්වේ. මෙහි අගය 6.022 x 1023 වන අතර ඒකකය mol-1 වේ.
ඇවගාඩ්රෝ නියතය (NA) = 6.022 x 1023 mol-1
- Ca 10g ක අඩංගු පරමාණු සංඛ්යාව ගණනය කරන්න.(Ca=40)
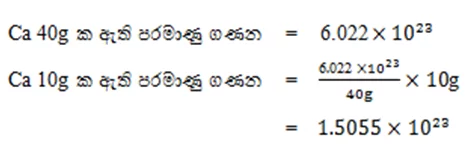
- Mg වල සාපේක්ෂ පරමාණුක ස්කන්ධය 24ක් වේ.Mg පරමාණුවක ස්කන්ධය ගණනය කරන්න.

- ස.උ.පී. දී
වායුවේ
පරිමාවක් තුළ ඇති අණු සංඛ්යාව ගණනය කරන්න.
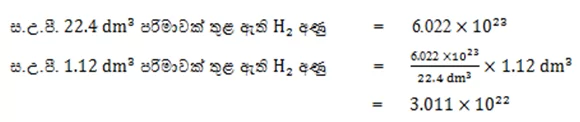
මවුලය
- පරමාණු අණු සහ අයන ඉතා විශාල සංඛ්යාවලින් පවතින බැවින් ගණනය කළ නොහැක. එවැනි ගණනය කළ නොහැකි ද්රව්ය මිනුම් සදහා අන්තර්ජාතිකව යොදාගන්නා ඒකකය මවුලය යි.
අර්ථ දැක්වීම
- 12C සමස්ථානිකයේ හරියටම 12.00 g ක් තුළ අන්තර්ගත පරමාණු සංඛ්යාවට සමාන කිසියම් ද්රව්යයක මූලික ඒකක සංඛ්යාවක් මවුලයක් ලෙස අර්ථ දැක්වේ. එම අගය 6.022 x 1023 වේ.
උදා: පරමාණු මවුලය = පරමාණු 6.022 x 1023 සංඛ්යාවක්
අණු මවුලය = අණු 6.022 x 1023 සංඛ්යාවක්
අයන මවුලය = අයන 6.022 x 1023 සංඛ්යාවක්
ඉලෙක්ට්රෝන මවුලය = ඉලෙක්ට්රෝන 6.022 x 1023 සංඛ්යාවක්
මවුලික ගුණ
කිසියම් ද්රව්යයක මවුල එකක් සතු ඕනෑම ගුණයක් මවුලික ගුණයක් ලෙස හැදින්වේ.
- මවුලික ස්කන්ධය
කිසියම් ද්රව්යයක මවුල 1 ක් සතු ස්කන්ධය එහි මවුලික ස්කන්ධය ලෙස හැදින්වේ.(gmol-1)
- මවුලික පරිමාව
කිසියම් ද්රව්යයක මවුල 1 ක් අත්කර ගන්නා පරිමාව එහි මවුලික පරිමාව ලෙස හැදින්වේ. (dm3mol-1) (ස.උ.පී. දී ඕනෑම වායුවක මවුලික පරිමාව 22.4 dm3mol-1 වේ.පරිපූර්ණ වන විට)
- මවුලික ආරෝපණය
කිසියම් ද්රව්යයක (ඉලෙ. , ප්රෝටෝන වැනි) මවුල 1 ක් සතු ආරෝපණය එහි මවුලික ආරෝපණය ලෙස හැදින්වේ. (Cmol-1)
මවුලය සම්බන්ධ ගණනය කිරීම්
මේ සදහා පහත ගණිතමය ප්රකාශන භාවිතා කළ හැක.

අණු ගණන = මවුල ගණන x 6.022 x 1023
පරමාණු ගණන = මවුල ගණන x 6.022 x 1023 x අණුවක ඇති පරමාණු ගණන
අයන ගණන = මවුල ගණන x 6.022 x 1023 x සූත්රයේ ඇති අයන ගණන
උදා :01. Ca 1 g ක් තුළ අඩන්ගු Ca මවුල සංඛ්යාව ගණනය කරන්න.
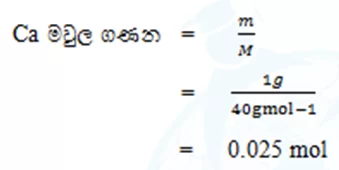
02. ඇසිටික් අම්ලයේ(CH3COOH) 1.2g ක් තුළ අඩංගු ඇසිටික් අම්ල මවුල සංඛ්යාව ගණනය කරන්න.(C=12,O=16,H=1)

03. BaCl2 ජලීය ද්රාවණයකට ත.H2SO4
දැමූ විට සෑදුණ BaSO4
අවක්ෂේපයේ මවුල සංඛ්යාව 0.003 mol විය.
BaSO4 වල ස්කන්ධය ගණනය කරන්න.(Ba=137,S=32,O=16)
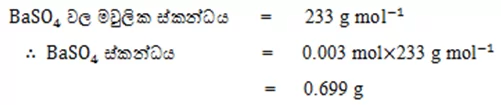
04. මෙතේන් වායුවේ(CH4) 0.4g ක් තුළ අඩංගු H පරමාණු සංඛ්යාව ගණනය කරන්න.
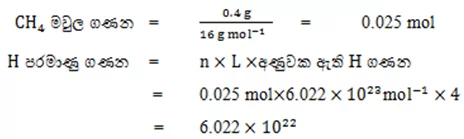
05. NaCl ජලීය ද්රාවණයක් තුළ අඩංගු NaCl ස්කන්ධය 0.117 g වේ.මෙම ද්රාවණයේ අඩංගු මුළු අයන සංඛ්යාව ගණනය කරන්න.
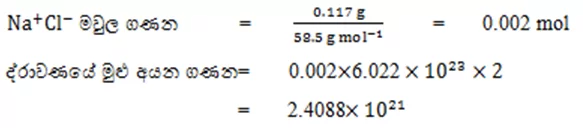
06. ස.උ.පී. දී මෙතේන් වායුවේ
0.112dm3 තුළ අඩංගු CH4
මවුල සංඛ්යාව ගණනය කරන්න.(ස.උ.පී. දී වායුවක මවුලික පරිමාව=22.4 dm3
mol-1)

07. ජලීය ද්රාවණයක් තුළ අඩංගු වල ස්කන්ධය 0.71 g වේ.මෙම ද්රාවණයේ
වල ආරෝපණ ප්රමාණය ගණනය කරන්න. (Cl =35.5)
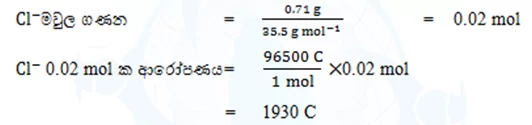
මිශ්රණ වල සංයුති
- සංඝටක 2ක් හෝ ඊට වැඩි සංඛ්යාවක් මිශ්ර කිරීමෙන් මිශ්රණයක් ලැබේ. මෙහි දී එම සංඝටක සියල්ල එකම භොතික කලාපයක ( ඝන හෝ ද්රව හෝ වායු හෝ ජලීය) පවතීනම් එය සමජාතීය මිශ්රණයකි. භොතික කලාප වෙනස් නම් එය විෂමජාතීය මිශ්රණයකි. මෙහි දී සමජාතීය මිශ්රණ පමණක් සලකා බැලේ.
- සමජාතීය මිශ්රණයක ඇති කිසියම් සංඝටකයක සංයුතිය ආකාර කිහිපයකින් ප්රකාශ කළ හැක.
- ස්කන්ධ භාගය
- මවුල භාගය
- පරිමා භාගය
- ස්කන්ධ/ පරිමා අනුපාතය
- මවුලීය අනුපාතය
ස්කන්ධ භාගය (w/w)
කිසියම් සංඝටකයක ස්කන්ධය මුළු ස්කන්ධයෙන් බෙදූ විට ලැබෙන අනුපාතය ස්කන්ධ භාගය ලෙස හැදින්වේ.
කිසියම් මිශ්රණයක A හා B ලෙස සංඝටක 2ක් පමණක් ඇත්නම්
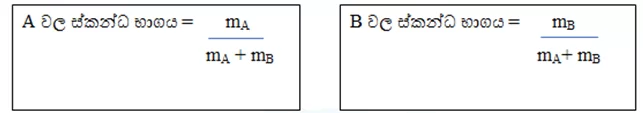
මිශ්රණයක ඇති සියලුම සංඝටකවල ස්කන්ධ භාගයන්ගේ ඓක්යය 1ට සමාන වේ.
ඉහත මිශ්රණය සදහා ස්කන්ධ භාගය පහත ආකාර වලින් ද ප්රකාශ කළ හැක.
- ස්කන්ධ ප්රතිශතය
ස්කන්ධ භාගය 100න් ගුණ කළ විට ස්කන්ධ ප්රතිශතය ලැබේ.
- ppm (parts per million-මිලියනයකට කොටස් )
මිශ්රණයක 1kg ක් තුළ අන්තර්ගත කිසියම් සංඝටකයක mg ප්රමාණය ppm ලෙස හැදින්වේ.
ppm = mg kg-1
- ppb (parts per billion – බිලියනයකට කොටස් )
මිශ්රණයක 1kg ක් තුළ අන්තර්ගත කිසියම් සංඝටකයක µg ප්රමාණය ppm ලෙස හැදින්වේ.
ppb = µg kg-1
මිශ්රණයක අඩන්ගු කිසියම් සංඝටකයක ප්රමාණය ඉතා කුඩා වන විට එහි සංයුතිය ප්රකාශ කිරීමට ppm භාවිතා කෙරේ.
තවදුරටත් කුඩා වන විට ppb භාවිතා කෙරේ.
- NaOH 50 g ක් ජලය 200 g ක් තුළ දිය කිරීමෙන් ලැබෙන ද්රාවණයේ NaOH වල ස්කන්ධ භාගය ගණනය කරන්න.

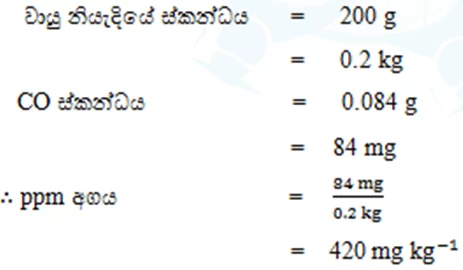
- දූෂිත වායු නියැදියක 200 g ක් තුළ CO 0.084 g ක් අඩංගු වේ.වායු නියැදියේ CO අන්තර්ගතය ppm වලින් දක්වන්න.
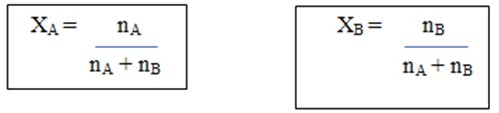
මවුල භාගය (X)
- මිශ්රණයක අන්තර්ගත කිසියම් සංඝටකයක මවුල සංඛ්යාව, මිශ්රණයේ මුළු මවුල සංඛ්යාවට දරන අනුපාතය මවුල භාගය ලෙස හැදින්වේ.
- කිසියම් මිශ්රණයක A හා B ලෙස සංඝටක 2ක් පමණක් ඇත්නම්
- මිශ්රණයේ සියලුම සංඝටකවල මවුල භාගවල එකතුව 1ට සමාන වේ.
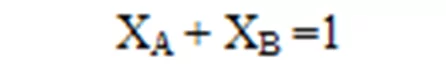
මවුල භාගය 100න් ගුණ කළ විට මවුල ප්රතිශතය ලැබේ.
- වායුමය මිශ්රණයක් තුළ O2
වලින් 0.025 mol සහ N2
වලින් 0.1 mol පමණක් අඩංගු වේ.වායු දෙකෙහි මවුල භාග ගණනය කරන්න.

- ජලය 7.2 g ක් තුළ X නැමති සංයෝගයකින් 4 g ක් දිය වී ඇත.මෙම ද්රාවණයේ X හි මවුල භාගය 0.2ක් වේ නම් X වල සා.අ.ස්. ගණනය කරන්න.(O=16,H=1)
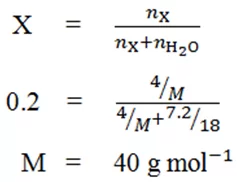
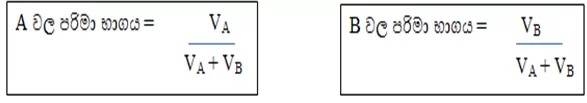
පරිමා භාගය (V/V)
මිශ්රණයක ඇති කිසියම් සංඝටකයක පරිමාව , මිශ්රණයේ මුළු පරිමාවට දරන අනුපාතය පරිමා භාගය ලෙස හැදින්වේ.
කිසියම් මිශ්රණයක A හා B ලෙස සංඝටක 2ක් පමණක් ඇත්නම්
- මවුල භාගය 100න් ගුණ කළ විට මවුල ප්රතිශතය ලැබේ.
- ppm
මිශ්රණයේ 1L වල අන්තර්ගත කිසියම් සංඝටකයක µL ප්රමාණය, ppm ලෙස හැදින්වේ.
- ඇසිටික් අම්ල ද්රාවණයකින් 200 cm3 ක් ජලය 300 cm3 ක් තුළ දිය කරන ලදි.මෙහි දි සිදුවන පරිමා විපර්යාසය නොගිනිය හැකි තරම් වේ නම් ද්රාවණයේ ඇසිටික් අම්ල පරිමා භාගය ගණනය කරන්න.
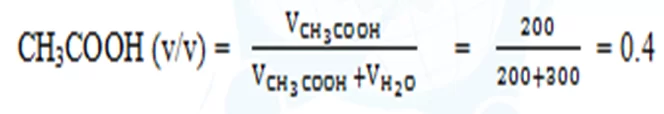
ස්කන්ධ / පරිමා අනුපාතය
- මිශ්රණයක කිසියම් සංඝටකයක ස්කන්ධය මිශ්රණයේ පරිමාවෙන් බෙදූ විට මෙම අගය ලැබේ.
- මෙහි දී ස්කන්ධය ලෙස µg, mg, g සහ kg ඒකක භාවිතා කළ හැක. පරිමාව ලෙස ම ml, l, cm3, dm3, m3 වැනි ඒකක භාවිතා කළ හැක.
- එම නිසා ස්කන්ධ පරිමා අගය සදහා පහත ආකාරයේ ඒකක ඇත.
µg dm-3 , mg dm-3, g dm-3, g m-3, kg m-3
මවුලීයතාවය
- කිසියම් ද්රාව්යයක් , ද්රාවකයක් තුළ දිය කිරීමෙන් ද්රාවණයක් ලැබේ.

- මෙහි දී දිය කරන සංඝටකය ද්රාව්යය ලෙස ද එය දිය කිරීමට යොදා ගන්නා මාධ්යය ද්රාවකය ලෙස ද හැදින්වේ.
උදා: ග්ලූකෝස් ජලයෙහි දිය කළ විට , ද්රාව්යය ග්ලූකෝස් වේ. ද්රාවකය ජලය වේ. (මෙහි දී සංඝටක දෙකම එකම භොතික අවස්ථාවක පවතී නම් අඩු මවුල සංඛ්යාවක් සහිත සංඝටකය ද්රාව්යය වේ.
අර්ථ දැක්වීම
- ද්රාවක 1kg ක් තුළ අඩන්ගු ද්රාව්යයේ මවුල සංඛ්යාව ම්වුලීයතාවය ලෙස හැදින්වේ.
- ඒකකය = molkg-1
- ජලය 100g ක් තුළ NaOH 2g ක් දියකළ විට ලැබෙන NaOH වල මවුලීයතාවය ගණනය කරන්න. ( Na=23 , O=16 , H=1 )
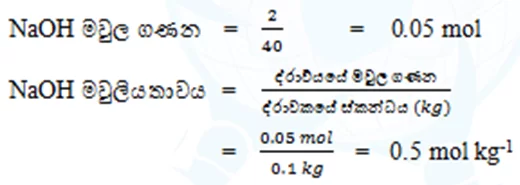
සාන්ද්රණය
- මිශ්රණයක සංයුතිය ප්රකාශ කිරීම සදහා රසායන විද්යාවේ දී බහුලවම යොදා ගන්නා සාධකය සාන්ද්රණය යි. මෙය මගින් ද්රාවණයක් තුළ කිසියම් ද්රාව්යයක් පැතිර ඇති ප්රමාණය පිළිබද මිනුමක් ලැබේ.
උදා: ජලය 1dm3 තුළ NaOH මවුල 1 ක් 2 ක් බැගින් දිය කළ අවස්ථාවක් සලකන්න.

A B
NaOH මවුල 1 NaOH මවුල 2
- මෙහි B ද්රාවණය තුළ NaOH පැතිර ඇති ප්රමාණය වැඩි යි. එම නිසා A ට වඩා B වල NaOH සාන්ද්රණය වැඩි යි.
සාන්ද්රණයේ අර්ථ දැක්වීම
- ද්රාවණයක ඒකීය පරිමාවක් තුළ දිය වී ඇති ද්රාව්යයේ ප්රමාණය සාන්ද්රණය ලෙස හැදින්වේ.

සාන්ද්රණයේ SI ඒකකය – molm-3
සාන්ද්රණයේ සාමාන්ය ඒකකය – moldm-3
මෙහි දී ලැබෙන අගය මවුලිකතාවය ලෙස හැදින්වේ.(M)
M = moldm-3
අනෙකුත් ඒකක
- ppm
ද්රාවණ 1 dm3 ක අන්තර්ගත ද්රාව්යයේ mg ප්රමාණය ppm ලෙස හැදින්වේ.
ppm = mgdm-3
- ppb
ද්රාවණ 1 dm3 ක අන්තර්ගත ද්රාව්යයේ µg ප්රමාණය ppb ලෙස හැදින්වේ.
ppb = µgdm-3
සාන්ද්රණය සම්බන්ධ ගණනය කිරීම්
- ඒකක පරිවර්තන සම්බන්ධ ගැටලු
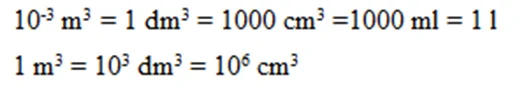
සාන්ද්රණය සම්බන්ධ සියලුම ගණනය කිරීම් වල දී පහත සමීකරණ දෙක වැදගත් වේ.

- 2 mol m-3 Na2CO3 ජලීය ද්රාවණයක් තුළ ඇති Na2CO3 මවුලිකතාවය ගණනය කරන්න.
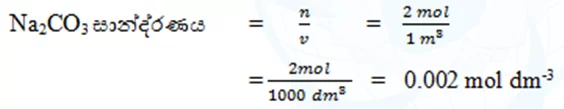
- දූෂිත CO වායු නියැදියක සාන්ද්රණය 0.005 mol dm-3. මෙහි CO අන්තර්ගතය ppm වලින් සොයන්න.
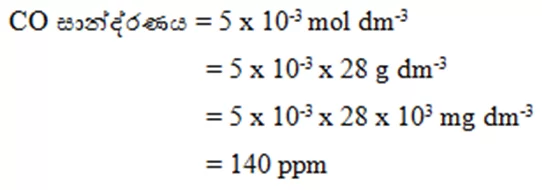
- සාන්ද්රණය , මවුල සංඛ්යා, ස්කන්ධ සෙවීම සම්බන්ධ ගණනය කිරීම්
- NaOH 0.12g ක් ජලයේ දිය කර ද්රාවණ 250 cm3 ක් සාදා ගන්නා ලදි. මෙම ද්රාවණයේ NaOH සාණ්ද්රණය සොයන්න. ( Na=23 , 0=16 , H=1 )
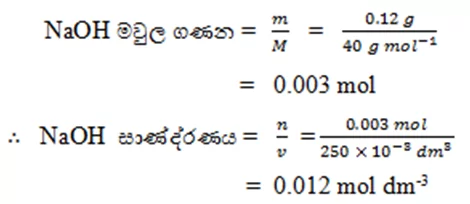
- සජල ලවණ සම්බන්ධ ගණනය කිරීම්
සජල ලවණ යනු ජල අණු සහිත ඝන ස්ඵටික විශේෂයකි. කිසියම් නිර්ජල ලවණයක් වාතයට නිරාවරණය කළ විට ඇති ජල වාෂ්ප අවශෝෂණය කර සජල ලවණයක් බවට පත් වේ.
උදා: නිර්ජල CuSO4 සුදු පැහැති එය වාතයට නිරාවරණය කළ විට නිල් පැහැ වේ. මෙයට හේතුව වාතයේ ඇති ජල අණු අවශෝෂණය කර සජල ලවණයක් බවට පත් වීමයි.
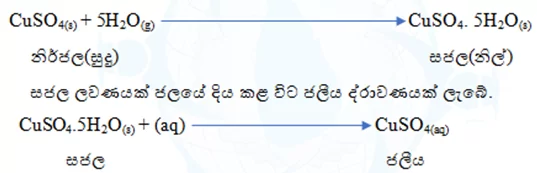
- මෙහි දී සජල ලවණයේ මවුල සංඛ්යාවත් ජලීය ලවණයේ මවුල සංඛ්යාවත් එක සමාන වේ.
- NaCl xH2O ස්පඨිකයෙන් 7.425g ක් ජලයේ දියකර ද්රාවණ 400 cm3 ක් සාදාගන්නා ලදි. මෙම ද්රාවණයේ NaCl සාන්ද්රණය 0.125 mol dm-3 වේ. මෙහි x වල අගය ගණනය කරන්න.
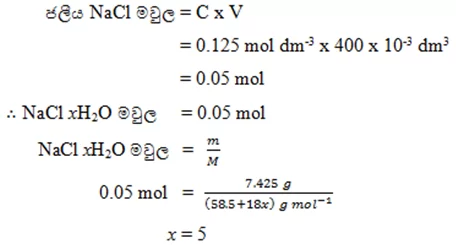
- වාණිජ අම්ල සම්බන්ධ ගණනය කිරීම්
- වාණිජ H2SO4 අම්ල ද්රාවණයක ස්කන්ධය අනුව 98% H2SO4 අඩංගු වේ. මෙම ද්රාවණයේ ඝනත්වය 1.84 g cm-3 වේ නම් H2SO4 සාන්ද්රණය ගණනය කරන්න.

- ද්රාවක තනුක කිරීම සම්බන්ධ ගණනය කිරීම්
දෙන ලද ද්රාවණයක් තනුක කළ විට ලැබෙන නව ද්රාවණයේ සාන්ද්රණය පහත සමීකරණය මගින් සෙවිය හැක.

- 0.2 mol dm-3 NaOH ද්රාවණයකින් 25 cm3 ක් ගෙන මුළු පරිමාව 500 cm3 වන තෙක් ආස්රැත ජලයෙන් තනුක කරනු ලැබේ.නව ද්රාවණයේ NaOH සාන්ද්රණය ගණනය කරන්න.
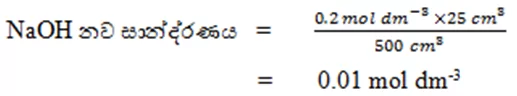
- ද්රාවණ මිශ්ර කළ විට ලැබෙන නව ද්රාවණවල සාන්ද්රණ සෙවීම
- 0.1 mol dm-3 HCl ද්රාවණයකින් 100 cm3 ක් සමඟ 0.2 mol dm-3 HCl ද්රාවණයකින් 150 cm3 ක් මිශ්ර කළ විට ලැබෙන නව ද්රාවණයේ HCl සාන්ද්රණය ගණනය කරන්න.
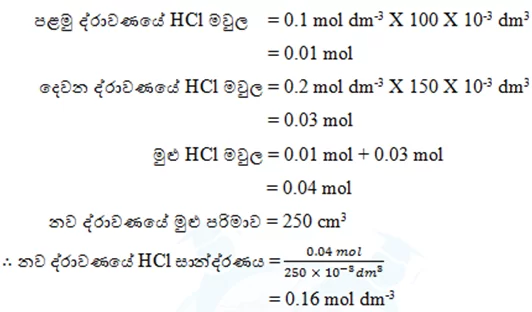
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



