02.03.01 සංයුජතා කවච ඉලෙක්ට්රෝන යුගල විකර්ෂණ වාදය (VSEPR වාදය)
ඒකකය 02 – ව්යූහය හා බන්ධන
අණු හා අයනවල මධ්ය පරමාණුව වටා බන්ධන ඉලෙක්ට්රෝන යුගල පවතී. එකසර ඉලෙක්ට්රෝන යුගලද පැවතිය හැකියි.
එම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණය අවම වන පරිදි බන්ධන පිහිටීමෙන් ඒවාට ජ්යාමිතික හැඩයන් ලැබේ
මේ පිළිබද මුලින්ම අදහසක් ඉදිරිපත් කලේ රොනල්ඩ් ගිලෙස්පි හා රොනල්ඩ් සිඩ්නි දේපල විසිනි.
මෙම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණ බල වල ප්රබලතාවය පහත අනුපිලිවෙලට වැඩිවේ.
බන්ධන-බන්ධන ඉලෙක්ට්රෝන යුගල < බන්ධන-එකසර ඉලෙක්ට්රෝන යුගල < එකසර-එකසර ඉලෙක්ට්රෝන යුගල
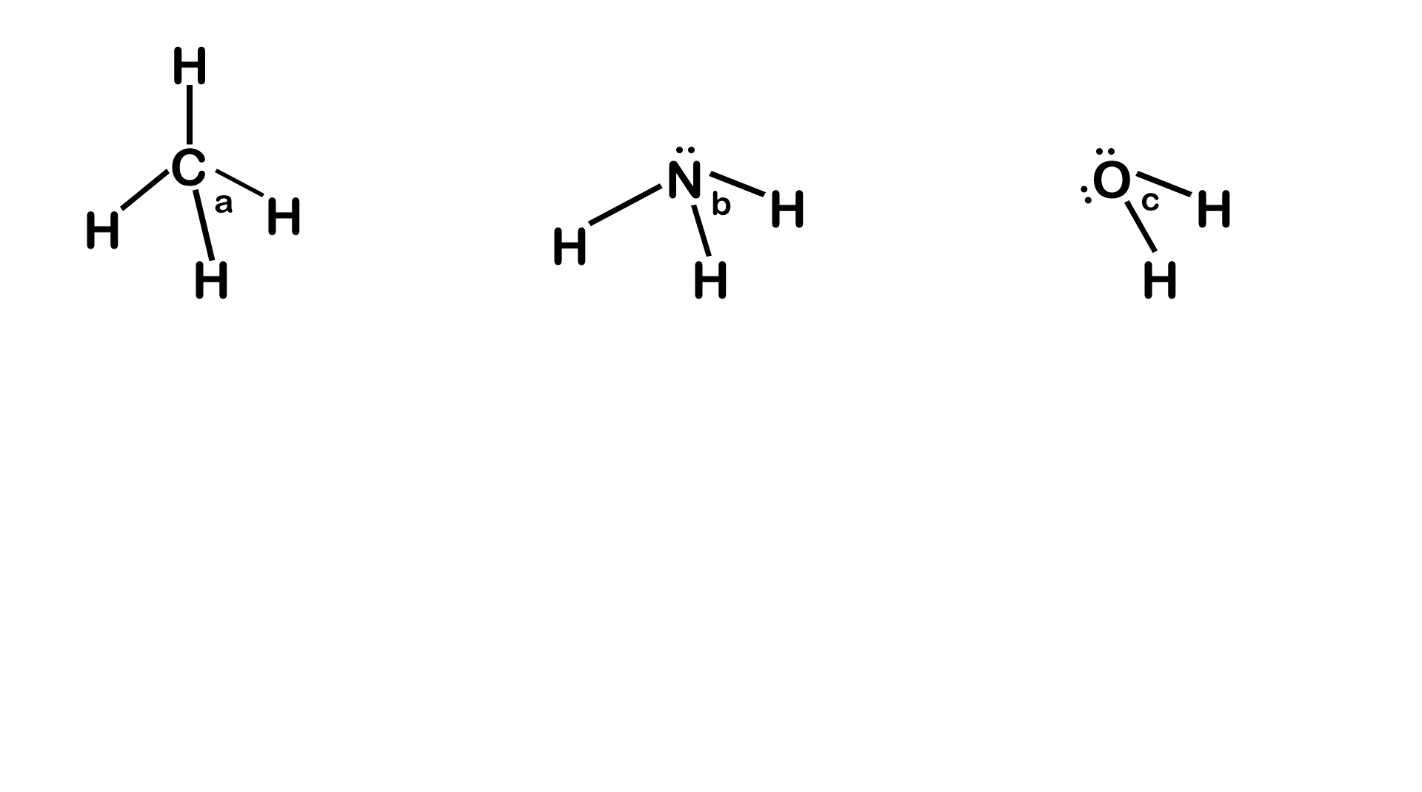 උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
- මෙහි CH4 වල C වටා බන්ධන ඉලෙක්ට්රෝන යුගල 4ක් පමණක් ඇත.
- NH3 වල N වටා බන්ධන ඉලෙක්ට්රෝන යුගල 3ක් හා එකසර යුගල එකක් ඇත.
- H2O වල Hවටා බන්ධන ඉලෙක්ට්රෝන යුගල 2ක් හා එකසර යුගල 2ක් ඇත.
- මේවායේ විකර්ෂණ බල වල ප්රබලතාව,
- a > b > c ලෙස අඩුවේ.
ඉහත උදාහරණයට අනුව බන්ධන සංඛ්යාව හා එකසර යුගල සංඛ්යාව අනුව අණුවෙහි හැඩය වෙනස් වී ඇත.
අණුවක හෝ අයනයක හැඩය නිගමනය කිරීමට සාධක 2ක් අවශ්ය වේ.
- මධ්ය පරමාණුව වට ඇති බන්ධන ගණන
- මධ්ය පරමාණුව වටා ඇති එකසර යුගල ගණන
මෙම ඉලෙක්ට්රෝන යුගල වර්ග (එක බන්ධන, ද්විත්ව බන්ධන, ත්රිත්ව බන්ධන හා එකසර යුගල) විකර්ෂණ ඒකක (VSEPR ඒකක) ලෙස හදුන්වයි.
ද්විත්ව බන්ධන හා ත්රිත්ව බන්ධන ද තනි විකර්ෂණ ඒකකයක් ලෙස සැලකේ.
විකර්ෂණ එකක ගණන අනුව අණුවක හෝ යනයක හැඩය (ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය ) සොයා බලමු.
|
විකර්ෂණ ඒකක ගණන |
විකර්ෂණ ඒකක වල පිහිටීම |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
|
2 |
රේඛිය |
|
|
3 |
තලීය ත්රිකෝණාකාර |
|
|
4 |
චතුස්තලීය |
|
|
5 |
ත්රිආනති ද්විපිරමිඩ |
|
|
6 |
අෂ්ටතලීය |
|
|
7 |
පංචාස්ර දවිපිරමිඩ |
දැන් බන්ධන ඉලෙක්ට්රෝන යුගල සංඛ්යාව හා එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව අනුව අණුවක හැඩය සලක බලමු.
|
බන්ධන ගණන |
එකසර ඉලෙක්ට්රෝන ගණන |
විකර්ෂණ ඒකක ගණන |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
ජ්යාමිතික හැඩය |
|
|
2 |
0 |
2 |
රේඛිය |
රේඛිය |
|
|
2 |
1 |
3 |
තලීය ත්රිකෝණාකාර |
.. |
කෝණික |
|
2 |
2 |
4 |
චතුස්තලීය |
.. .. |
කෝණික |
|
2 |
3 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. .. |
රේඛිය |
|
3 |
0 |
3 |
තලීය ත්රිකෝණාකාර |
තලීය ත්රිකෝණාකාර |
|
|
3 |
1 |
4 |
චතුස්තලීය |
.. |
ත්රි ආනති පිරමිඩ |
|
3 |
2 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. |
T-හැඩය |
|
4 |
0 |
4 |
චතුස්තලීය |
චතුස්තලීය |
|
|
4 |
1 |
5 |
ත්රි ආනති ද්විපිරමිඩ |
.. |
සී-සෝ හැඩය |
|
4 |
2 |
6 |
අෂ්ටතලීය |
.. .. |
තලීය සමචතුරස්රකාර |
|
5 |
0 |
5 |
ත්රිආනති ද්විපිරමිඩ |
ත්රිආනති ද්විපිරමිඩ |
|
|
5 |
1 |
6 |
අෂ්ටතලීය |
.. |
සමචතුරස්ර පිරමිඩ |
|
6 |
0 |
6 |
අෂ්ටතලීය |
අෂ්ටතලීය |
|
|
7 |
0 |
7 |
පංචාස්ර දවිපිරමිඩ |
පංචාස්ර දවිපිරමිඩ |
අණුවල හැඩ ව්යුත්පන්න කිරීම.
- මෙහිදී පළමුව අණුවෙහි දළ ව්යූහය (බන්ධන ස්වභාවය) අඳීනු ලැබේ.
- එම ව්යුහය මඟින් මධ්ය පරමාණුව වට ඇති එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව ගණනය කෙරේ. එවිට බන්ධන ගණන හා එකසර යුගල ගණන දන්නා බැවින් හැඩය නිගමනය කල හැක
- එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව සෙවීමේදී මධ්ය පරමාණුවෙන් ලබාදෙන ඉලෙක්ට්රෝන ගණන එය ආවර්තිතා වගුවේ පිහිටි කාණ්ඩ අංකයට සමාන වේ.
උදා – 1) BeCl2
- මධ්ය පරමාණුව Be වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 4
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 2
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 2
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 2 – 2
= 0
- Be මධ්ය පරමාණුව වටා බන්ධන 2ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය රේඛිය වේ.
- CH2Cl2
- මධ්ය පරමාණුව C වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 4
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- H පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 8
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 4
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 4
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 4 – 4
= 0
- C මධ්ය පරමාණුව වටා බන්ධන 4ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය චතුස්තලීය වේ.
02.03.01 සංයුජතා කවච ඉලෙක්ට්රෝන යුගල විකර්ෂණ වාදය (VSEPR වාදය)
ඒකකය 02 – ව්යූහය හා බන්ධන
අණු හා අයනවල මධ්ය පරමාණුව වටා බන්ධන ඉලෙක්ට්රෝන යුගල පවතී. එකසර ඉලෙක්ට්රෝන යුගලද පැවතිය හැකියි.
එම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණය අවම වන පරිදි බන්ධන පිහිටීමෙන් ඒවාට ජ්යාමිතික හැඩයන් ලැබේ
මේ පිළිබද මුලින්ම අදහසක් ඉදිරිපත් කලේ රොනල්ඩ් ගිලෙස්පි හා රොනල්ඩ් සිඩ්නි දේපල විසිනි.
මෙම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණ බල වල ප්රබලතාවය පහත අනුපිලිවෙලට වැඩිවේ.
බන්ධන-බන්ධන ඉලෙක්ට්රෝන යුගල < බන්ධන-එකසර ඉලෙක්ට්රෝන යුගල < එකසර-එකසර ඉලෙක්ට්රෝන යුගල
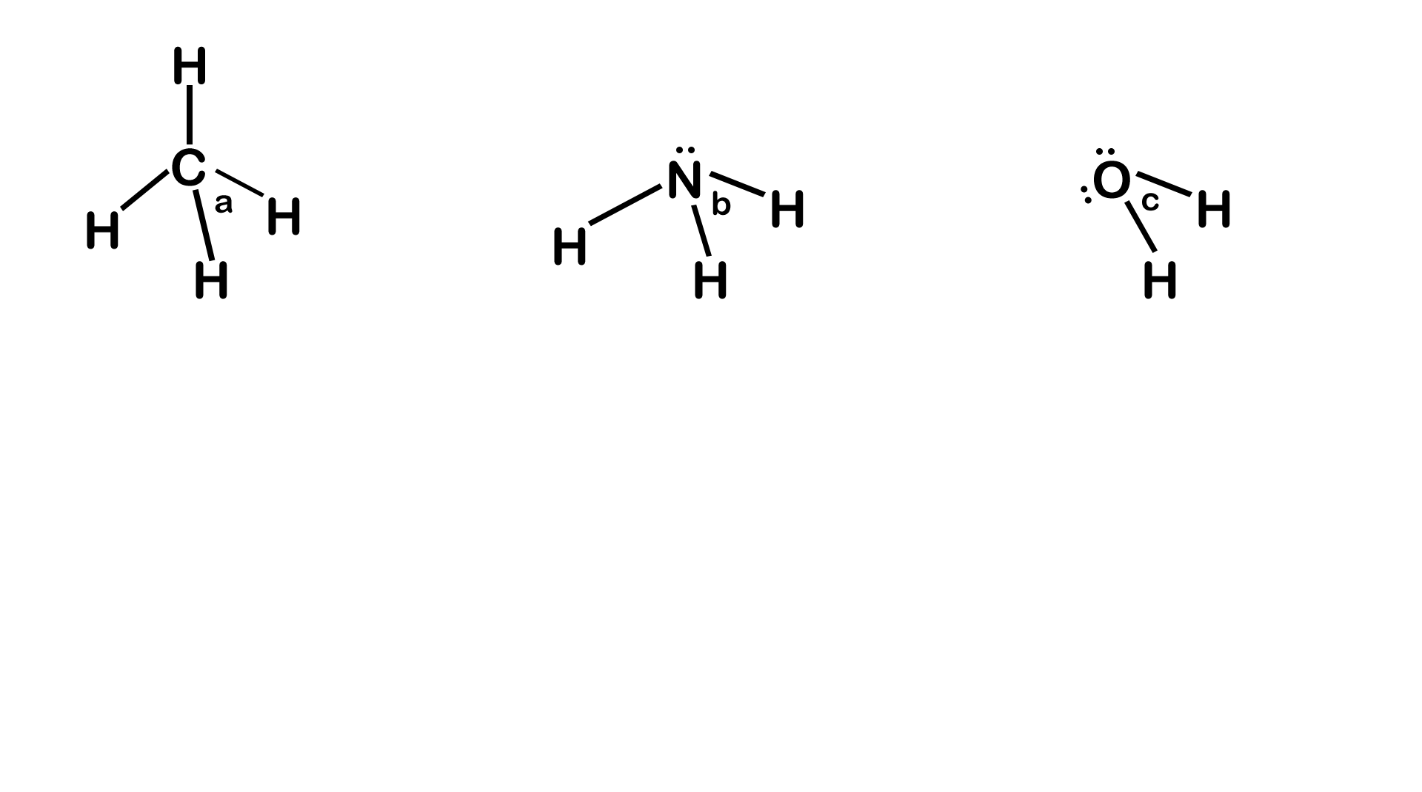 උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
- මෙහි CH4 වල C වටා බන්ධන ඉලෙක්ට්රෝන යුගල 4ක් පමණක් ඇත.
- NH3 වල N වටා බන්ධන ඉලෙක්ට්රෝන යුගල 3ක් හා එකසර යුගල එකක් ඇත.
- H2O වල Hවටා බන්ධන ඉලෙක්ට්රෝන යුගල 2ක් හා එකසර යුගල 2ක් ඇත.
- මේවායේ විකර්ෂණ බල වල ප්රබලතාව,
- a > b > c ලෙස අඩුවේ.
ඉහත උදාහරණයට අනුව බන්ධන සංඛ්යාව හා එකසර යුගල සංඛ්යාව අනුව අණුවෙහි හැඩය වෙනස් වී ඇත.
අණුවක හෝ අයනයක හැඩය නිගමනය කිරීමට සාධක 2ක් අවශ්ය වේ.
- මධ්ය පරමාණුව වට ඇති බන්ධන ගණන
- මධ්ය පරමාණුව වටා ඇති එකසර යුගල ගණන
මෙම ඉලෙක්ට්රෝන යුගල වර්ග (එක බන්ධන, ද්විත්ව බන්ධන, ත්රිත්ව බන්ධන හා එකසර යුගල) විකර්ෂණ ඒකක (VSEPR ඒකක) ලෙස හදුන්වයි.
ද්විත්ව බන්ධන හා ත්රිත්ව බන්ධන ද තනි විකර්ෂණ ඒකකයක් ලෙස සැලකේ.
විකර්ෂණ එකක ගණන අනුව අණුවක හෝ යනයක හැඩය (ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය ) සොයා බලමු.
|
විකර්ෂණ ඒකක ගණන |
විකර්ෂණ ඒකක වල පිහිටීම |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
|
2 |
රේඛිය |
|
|
3 |
තලීය ත්රිකෝණාකාර |
|
|
4 |
චතුස්තලීය |
|
|
5 |
ත්රිආනති ද්විපිරමිඩ |
|
|
6 |
අෂ්ටතලීය |
|
|
7 |
පංචාස්ර දවිපිරමිඩ |
දැන් බන්ධන ඉලෙක්ට්රෝන යුගල සංඛ්යාව හා එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව අනුව අණුවක හැඩය සලක බලමු.
|
බන්ධන ගණන |
එකසර ඉලෙක්ට්රෝන ගණන |
විකර්ෂණ ඒකක ගණන |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
ජ්යාමිතික හැඩය |
|
|
2 |
0 |
2 |
රේඛිය |
රේඛිය |
|
|
2 |
1 |
3 |
තලීය ත්රිකෝණාකාර |
.. |
කෝණික |
|
2 |
2 |
4 |
චතුස්තලීය |
.. .. |
කෝණික |
|
2 |
3 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. .. |
රේඛිය |
|
3 |
0 |
3 |
තලීය ත්රිකෝණාකාර |
තලීය ත්රිකෝණාකාර |
|
|
3 |
1 |
4 |
චතුස්තලීය |
.. |
ත්රි ආනති පිරමිඩ |
|
3 |
2 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. |
T-හැඩය |
|
4 |
0 |
4 |
චතුස්තලීය |
චතුස්තලීය |
|
|
4 |
1 |
5 |
ත්රි ආනති ද්විපිරමිඩ |
.. |
සී-සෝ හැඩය |
|
4 |
2 |
6 |
අෂ්ටතලීය |
.. .. |
තලීය සමචතුරස්රකාර |
|
5 |
0 |
5 |
ත්රිආනති ද්විපිරමිඩ |
ත්රිආනති ද්විපිරමිඩ |
|
|
5 |
1 |
6 |
අෂ්ටතලීය |
.. |
සමචතුරස්ර පිරමිඩ |
|
6 |
0 |
6 |
අෂ්ටතලීය |
අෂ්ටතලීය |
|
|
7 |
0 |
7 |
පංචාස්ර දවිපිරමිඩ |
පංචාස්ර දවිපිරමිඩ |
අණුවල හැඩ ව්යුත්පන්න කිරීම.
- මෙහිදී පළමුව අණුවෙහි දළ ව්යූහය (බන්ධන ස්වභාවය) අඳීනු ලැබේ.
- එම ව්යුහය මඟින් මධ්ය පරමාණුව වට ඇති එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව ගණනය කෙරේ. එවිට බන්ධන ගණන හා එකසර යුගල ගණන දන්නා බැවින් හැඩය නිගමනය කල හැක
- එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව සෙවීමේදී මධ්ය පරමාණුවෙන් ලබාදෙන ඉලෙක්ට්රෝන ගණන එය ආවර්තිතා වගුවේ පිහිටි කාණ්ඩ අංකයට සමාන වේ.
උදා – 1) BeCl2
- මධ්ය පරමාණුව Be වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 4
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 2
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 2
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 2 – 2
= 0
- Be මධ්ය පරමාණුව වටා බන්ධන 2ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය රේඛිය වේ.
- CH2Cl2
- මධ්ය පරමාණුව C වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 4
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- H පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 8
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 4
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 4
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 4 – 4
= 0
- C මධ්ය පරමාණුව වටා බන්ධන 4ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය චතුස්තලීය වේ.
02.03.01 සංයුජතා කවච ඉලෙක්ට්රෝන යුගල විකර්ෂණ වාදය (VSEPR වාදය)
ඒකකය 02 – ව්යූහය හා බන්ධන
අණු හා අයනවල මධ්ය පරමාණුව වටා බන්ධන ඉලෙක්ට්රෝන යුගල පවතී. එකසර ඉලෙක්ට්රෝන යුගලද පැවතිය හැකියි.
එම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණය අවම වන පරිදි බන්ධන පිහිටීමෙන් ඒවාට ජ්යාමිතික හැඩයන් ලැබේ
මේ පිළිබද මුලින්ම අදහසක් ඉදිරිපත් කලේ රොනල්ඩ් ගිලෙස්පි හා රොනල්ඩ් සිඩ්නි දේපල විසිනි.
මෙම ඉලෙක්ට්රෝන යුගල අතර විකර්ෂණ බල වල ප්රබලතාවය පහත අනුපිලිවෙලට වැඩිවේ.
බන්ධන-බන්ධන ඉලෙක්ට්රෝන යුගල < බන්ධන-එකසර ඉලෙක්ට්රෝන යුගල < එකසර-එකසර ඉලෙක්ට්රෝන යුගල
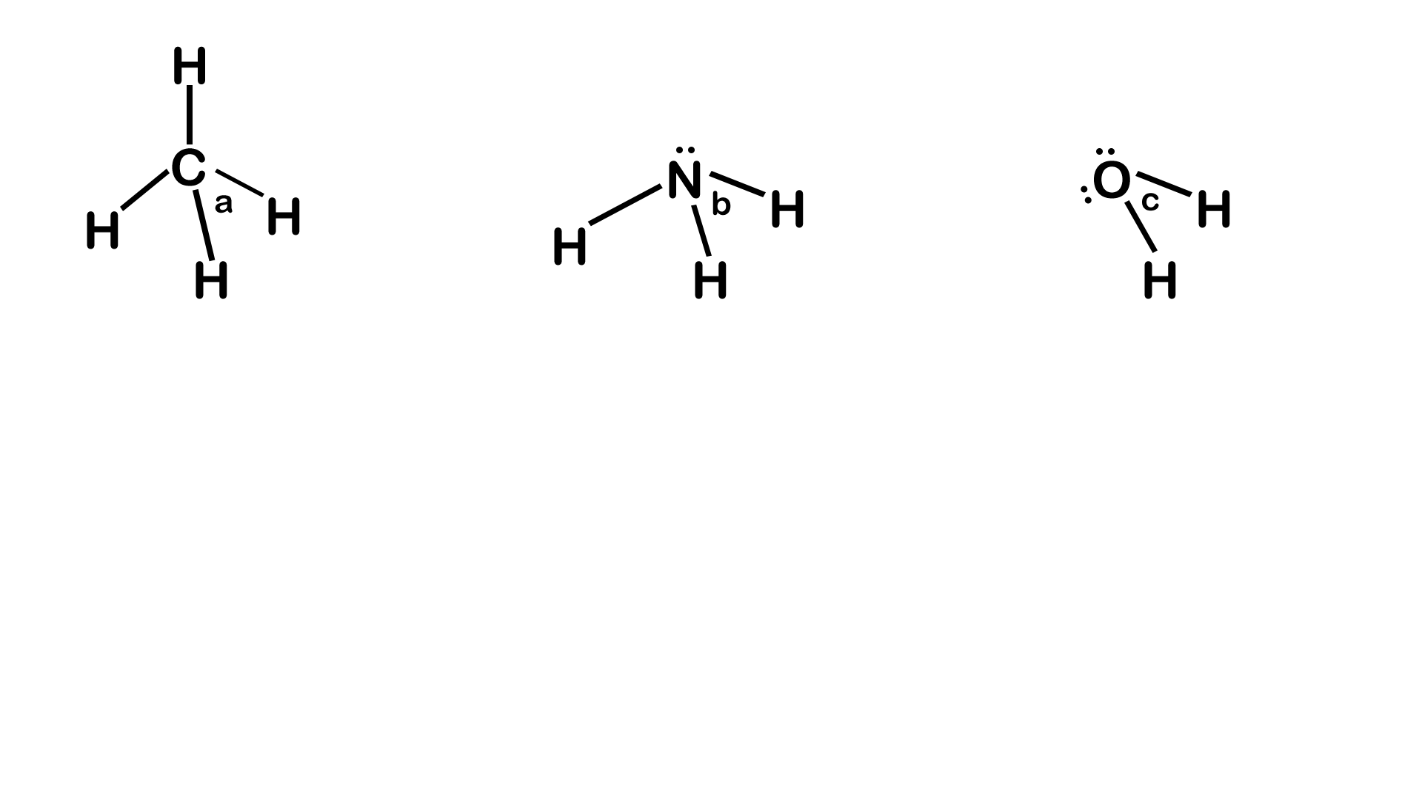 උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
උදා – CH4, NH3 හා H2O වල බන්ධන පහත ලෙස දිශානති වී ඇත.
- මෙහි CH4 වල C වටා බන්ධන ඉලෙක්ට්රෝන යුගල 4ක් පමණක් ඇත.
- NH3 වල N වටා බන්ධන ඉලෙක්ට්රෝන යුගල 3ක් හා එකසර යුගල එකක් ඇත.
- H2O වල Hවටා බන්ධන ඉලෙක්ට්රෝන යුගල 2ක් හා එකසර යුගල 2ක් ඇත.
- මේවායේ විකර්ෂණ බල වල ප්රබලතාව,
- a > b > c ලෙස අඩුවේ.
ඉහත උදාහරණයට අනුව බන්ධන සංඛ්යාව හා එකසර යුගල සංඛ්යාව අනුව අණුවෙහි හැඩය වෙනස් වී ඇත.
අණුවක හෝ අයනයක හැඩය නිගමනය කිරීමට සාධක 2ක් අවශ්ය වේ.
- මධ්ය පරමාණුව වට ඇති බන්ධන ගණන
- මධ්ය පරමාණුව වටා ඇති එකසර යුගල ගණන
මෙම ඉලෙක්ට්රෝන යුගල වර්ග (එක බන්ධන, ද්විත්ව බන්ධන, ත්රිත්ව බන්ධන හා එකසර යුගල) විකර්ෂණ ඒකක (VSEPR ඒකක) ලෙස හදුන්වයි.
ද්විත්ව බන්ධන හා ත්රිත්ව බන්ධන ද තනි විකර්ෂණ ඒකකයක් ලෙස සැලකේ.
විකර්ෂණ එකක ගණන අනුව අණුවක හෝ යනයක හැඩය (ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය ) සොයා බලමු.
|
විකර්ෂණ ඒකක ගණන |
විකර්ෂණ ඒකක වල පිහිටීම |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
|
2 |
රේඛිය |
|
|
3 |
තලීය ත්රිකෝණාකාර |
|
|
4 |
චතුස්තලීය |
|
|
5 |
ත්රිආනති ද්විපිරමිඩ |
|
|
6 |
අෂ්ටතලීය |
|
|
7 |
පංචාස්ර දවිපිරමිඩ |
දැන් බන්ධන ඉලෙක්ට්රෝන යුගල සංඛ්යාව හා එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව අනුව අණුවක හැඩය සලක බලමු.
|
බන්ධන ගණන |
එකසර ඉලෙක්ට්රෝන ගණන |
විකර්ෂණ ඒකක ගණන |
ඉලෙක්ට්රෝන යුගල ජ්යාමිතිය |
ජ්යාමිතික හැඩය |
|
|
2 |
0 |
2 |
රේඛිය |
රේඛිය |
|
|
2 |
1 |
3 |
තලීය ත්රිකෝණාකාර |
.. |
කෝණික |
|
2 |
2 |
4 |
චතුස්තලීය |
.. .. |
කෝණික |
|
2 |
3 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. .. |
රේඛිය |
|
3 |
0 |
3 |
තලීය ත්රිකෝණාකාර |
තලීය ත්රිකෝණාකාර |
|
|
3 |
1 |
4 |
චතුස්තලීය |
.. |
ත්රි ආනති පිරමිඩ |
|
3 |
2 |
5 |
ත්රිආනති ද්විපිරමිඩ |
.. .. |
T-හැඩය |
|
4 |
0 |
4 |
චතුස්තලීය |
චතුස්තලීය |
|
|
4 |
1 |
5 |
ත්රි ආනති ද්විපිරමිඩ |
.. |
සී-සෝ හැඩය |
|
4 |
2 |
6 |
අෂ්ටතලීය |
.. .. |
තලීය සමචතුරස්රකාර |
|
5 |
0 |
5 |
ත්රිආනති ද්විපිරමිඩ |
ත්රිආනති ද්විපිරමිඩ |
|
|
5 |
1 |
6 |
අෂ්ටතලීය |
.. |
සමචතුරස්ර පිරමිඩ |
|
6 |
0 |
6 |
අෂ්ටතලීය |
අෂ්ටතලීය |
|
|
7 |
0 |
7 |
පංචාස්ර දවිපිරමිඩ |
පංචාස්ර දවිපිරමිඩ |
අණුවල හැඩ ව්යුත්පන්න කිරීම.
- මෙහිදී පළමුව අණුවෙහි දළ ව්යූහය (බන්ධන ස්වභාවය) අඳීනු ලැබේ.
- එම ව්යුහය මඟින් මධ්ය පරමාණුව වට ඇති එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව ගණනය කෙරේ. එවිට බන්ධන ගණන හා එකසර යුගල ගණන දන්නා බැවින් හැඩය නිගමනය කල හැක
- එකසර ඉලෙක්ට්රෝන යුගල සංඛ්යාව සෙවීමේදී මධ්ය පරමාණුවෙන් ලබාදෙන ඉලෙක්ට්රෝන ගණන එය ආවර්තිතා වගුවේ පිහිටි කාණ්ඩ අංකයට සමාන වේ.
උදා – 1) BeCl2
- මධ්ය පරමාණුව Be වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 4
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 2
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 2
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 2 – 2
= 0
- Be මධ්ය පරමාණුව වටා බන්ධන 2ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය රේඛිය වේ.
- CH2Cl2
- මධ්ය පරමාණුව C වලින් ලැබෙන ඉලෙක්ට්රෝන ගණන = 4
- Cl පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- H පරමාණු 2න් ලැබෙන ඉලෙක්ට්රෝන ගණන = 2
- මුළු ඉලෙක්ට්රෝන ගණන = 8
- මුළු ඉලෙක්ට්රෝන යුගල ගණන = 4
- බන්ධන ඉලෙක්ට්රෝන යුගල ගණන = 4
- එකසර ඉලෙක්ට්රෝන යුගල ගණන = මුළු ඉලෙක්ට්රෝන යුගල ගණන – බන්ධන ඉලෙක්ට්රෝන යුගල ගණන
= 4 – 4
= 0
- C මධ්ය පරමාණුව වටා බන්ධන 4ක් පමණක් ඇත. එකසර යුගල නැත.
- එමනිසා හැඩය චතුස්තලීය වේ.