බන්ධනය සෑදීමට අවශ්ය කරන ඉලෙක්ට්රෝන යුගලය පරමාණු දෙකකින් එක බැඟින් ප්රධානය කර පරමාණු දෙක අතර ඉලෙක්ට්රෝන යුගල් එකක් දෙකක් හෝ තුනක් හවුලේ තබා ගනිමින් සාදනු ලබන බන්ධනය සහසංයුජ බන්ධනයක් ලෙස හැඳින්වේ.
නිර්ධ්රැවිය සහසංයුජ බන්ධන
- එකම වර්ගයේ පරමාණු දෙකක වියුග්ම ඉලෙක්ට්රෝන සහිත කාක්ෂික දෙකක් අතිච්ඡදානයෙන් ඇතිවන සහසංයුජ බන්ධනයයි.
- මේවායේ විද්යුත් සෘණතා වෙනස ශූන්ය වේ.
- මෙහිදී සෑදෙන අණුක කක්ෂිකය සමමිතික වේ.
ධ්රැවීය සහසංයුජ බන්ධන
- වෙනස් වර්ගයේ පරමාණු දෙකක වියුග්ම ඉලෙක්ට්රෝන සහිත කාක්ෂික දෙකක් අතිච්ඡදානයෙන් ඇතිවන සහසංයුජ බන්ධනයයි.
- මේවායේ විද්යුත් සෘණතා වෙනසක් ඇත.
- මෙහිදී සෑදෙන අණුක කක්ෂිකය අසමමිතික වේ.
- වඩා විද්යුත් සෘණ පරමාණුව දෙසට අණුක කක්ෂිකය ආකර්ෂණය වී පවතී.
සහසංයුජ ඒක බන්ධන
පරමාණු දෙකෙන් ඉලෙක්ට්රෝන එක බැගින් ප්රධානය කර පරමාණු දෙක අතර ඉලෙක්ට්රෝන යුගල එකක් හවුලේ තබා ගනිමින් සාදා ගන්නා බන්ධනය සහසංයුජ ඒක බන්ධනයක් ලෙස හැදින්වේ.
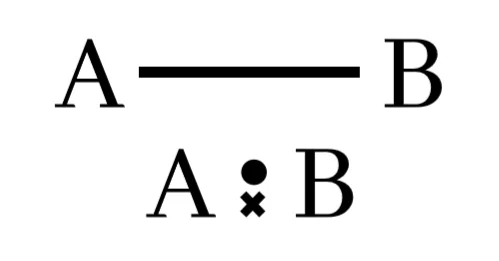
සහසංයුජ ද්විත්ව බන්ධන
පරමාණු දෙකෙන් ඉලෙක්ට්රෝන දෙක බැගින් ප්රධානය කර පරමාණු දෙක අතර ඉලෙක්ට්රෝන යුගල දෙකක් හවුලේ තබා ගනිමින් සාදා ගන්නා බන්ධනය සහසංයුජ ද්විත්ව බන්ධනයක් ලෙස හැදින්වේ.
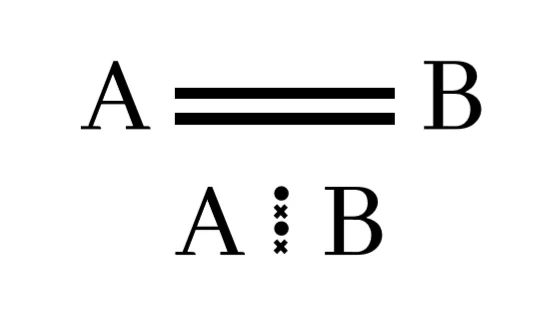
සහසංයුජ ත්රිත්ව බන්ධන
පරමාණු දෙකෙන් ඉලෙක්ට්රෝන තුන බැගින් ප්රධානය කර පරමාණු දෙක අතර ඉලෙක්ට්රෝන යුගල තුනක් හවුලේ තබා ගනිමින් සාදා ගන්නා බන්ධනය සහසංයුජ ත්රිත්වබන්ධනයක් ලෙස හැදින්වේ.
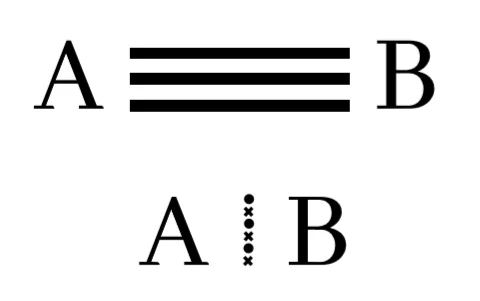
සහසංයුජ බන්ධන සෑදීමේදි ඉලෙක්ට්රෝන යුගල් හවුලේ තබා ගන්නා ආකාරය අනුව ප්රධාන වර්ග 2 කි.
- සිග්මා බන්ධන (σ)
- පයි බන්ධන (π)
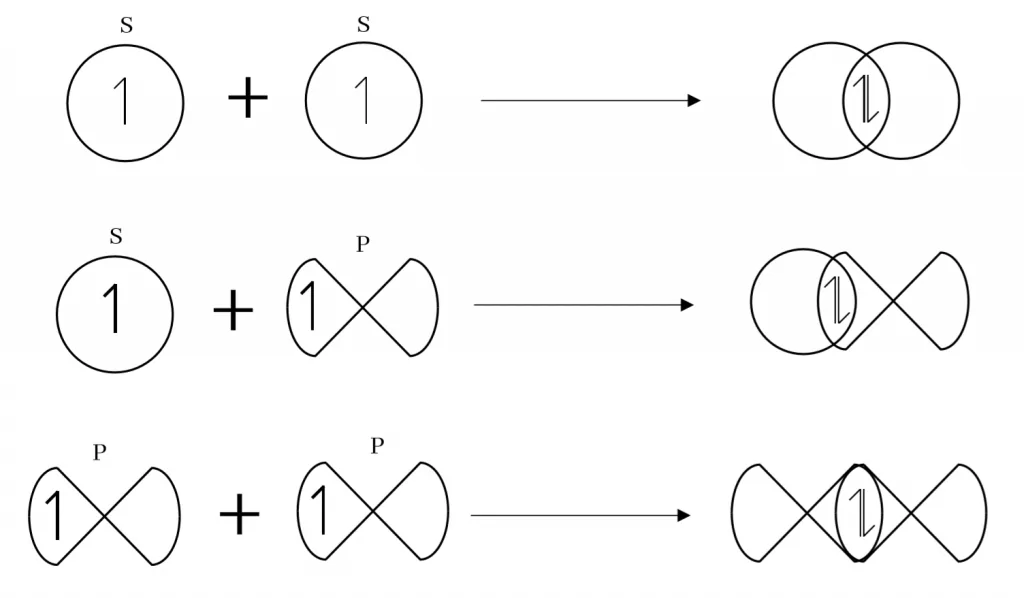
සිග්මා බන්ධන (σ)
පරමාණු දෙකෙහි පවතින වියුග්ම ඉලෙක්ට්රෝනක් බැගින් ඇති කාක්ෂික දෙකක් රේඛීය අතිච්ඡාදනයෙන් සාදනු ලබන සහසංයුජ බන්ධනය සිග්මා බන්ධනයක් ලෙස හැදින්වේ.
පරමාණු දෙකේ න්යෂ්ටි දෙක යා කරන රේඛාව අන්තර් න්යෂ්ටික රේඛාව ලෙස් හඳුන්වන අතර පරමාණුක කාක්ෂික අතිච්ඡාදනය වන්නේ එම රේඛාව දිගේ නම් එය රේඛීය අතිච්ඡාදනයක් ලෙස හැඳින්වේ.
S කාක්ෂික S සමඟත්, S කාක්ෂික P කාක්ෂික සමඟත්, P කාක්ෂික P කාක්ෂික සමඟත් සිදු කරන රේඛීය අතිච්ඡාදනය පහත ලෙස දැක්විය හැක.
පයි බන්ධන (π)
වියුග්ම ඉලෙක්ට්රෝනයක් බැගින් පවතින P කාක්ෂික දෙකක් අන්තර් න්යෂ්ටික රේඛාවේ සිට දෙපසින් සිදුවන එකතුවීම පාර්ශ්වික අතිච්ඡාදනයක් වේ.
මෙලෙස වියුග්ම ඉලෙක්ට්රෝන පවතින P කාක්ෂික දෙකක් පාර්ශ්වික අතිච්ඡාදනයෙන් සාදනු ලබන සහසංයුජ බන්ධනය පයි බන්ධනක් ලෙස හැදින්වේ.
- රේඛීය අතිච්ඡාදනයෙන් සාදන සිග්මා බන්ධනය පාර්ශ්වික අතිච්ඡාදනයෙන් සාදන පයි බන්ධනයට වඩා ශක්තිමත් වේ.
- පරමාණු 2ක් අතර තනි බන්ධනයක් ඇති විට එය සිග්මා බන්ධනයක් වේ.
- පරමාණු 2ක් අතර ද්විත්ව බන්ධනයක් ඇති විට ඉන් එකක් සිග්මා බන්ධනයක් වන අතර අනෙක පයි බන්ධනයක් වේ.
- පරමාණු 2ක් අතර ත්රිත්ව බන්ධනයක් ඇති විට ඉන් එකක් සිග්මා බන්ධනයක් වන අතර අනෙක් බන්ධන දෙකම පයි බන්ධනය වේ.
දායක බන්ධන (සංගත බන්ධන)
බන්ධනය සෑදීමට අවශ්ය ඉලෙක්ට්රෝන යුගලයට එක පරමාණුවකින් එම ඉලෙක්ට්රෝන යුගලය පරමාණු දෙක අතර හවුලේ තබා ගනිමින් සාදා ගනු ලබන බන්ධනය දායක බන්ධනයක් නම් වේ.
දායක බන්ධනය සෑදෙන විට ඉලෙක්ට්රෝන යුගලය ප්රධානය කරන ප්රබේදය දායක පරමාණුව වන අතර එහි අනිවාර්යෙන්ම එකසර යුගල් තිබිය යුතු වේ.
ඉලෙක්ට්රෝන යුගලය ලබා ගන්නා ප්රබේදය ප්රතිග්රාහක පරමාණුව වන අතර එහි හිස් කාක්ෂික තිබිය යුතු වේ.
දායක බන්ධනයක් ඇතිවෙන ආකාරය
- A යනු දායක පරමාණුද B යනු ප්රතිග්රාහක පරමාණුවද ලෙස සිතමු.
- පළමුව A ගෙන් එක් ඉලෙක්ට්රෝනයක් B පරමාණුව වෙත තාවකාලිකව ලබා දෙයි.
- ඉන්පසුව B වෙත ලැබුනු එම ඉලෙක්ට්රෝනයත් A මඟින් තවත් ඉලෙක්ට්රෝනයකුත් පරමාණු දෙක අතර හවුලේ තබා ගනිමින් බන්ධනයක් සාදා ගනු ලබයි.
- ඒ අනුව එම බන්ධනයට අවශ්ය ඉලෙක්ට්රෝන 2 ම ලැබුනේ A පරමාණුවෙනි.
දායක බන්ධනයක් නිරූපණය කරන්නේ පහත ලෙසය.

NH3 හා H+ අයනය අතර ඇතිවන දායක බන්ධනය
ඇමෝනියාහි N පරමාණුව මත එකසර යුගලයක් පවතින බැවින් දායක බන්ධනය සැදීමේදී එය දායක ප්රබේදය ලෙස් ක්රියා කල හැකිය.
H පරමාණුව H+ සාදන විට ඉලෙක්ට්රෝන 1 ක් ඉවත් කිරීම හේතුවෙන් 1S කාක්ෂිකය හිස් වේ. මේ නිසා H+ අයනයට ප්රතිග්රාහක ප්රබේදය ලෙස ක්රියා කල හැක.
මේ නිසා ඇමෝනියාහී N මත පවතින එකසර යුගලය H+ අයනයේ හිස් කාක්ෂිකයට ප්රදානය කරමින් පහත පරිදි දායක බන්ධනය සෑදීම සිදු වේ.
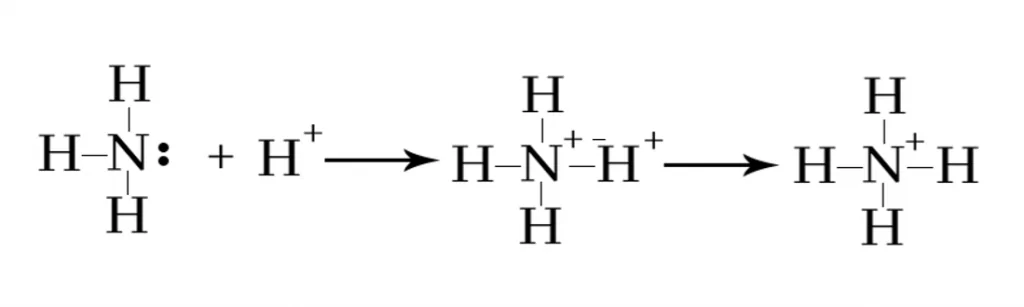
NH4+ අයනය තුල පවතින N-H බන්ධන හතරින් තුනක් සහසංයුජ බන්ධන වන අතර එකක් දායකයක් වේ. නමුත් NH4+ අයනයේදි එම දායක බන්ධනය නිශ්චිතව හඳුනාගත නොහැක.
සහසංයුජ සංයෝග වල ගුණ.
- කාමර උෂ්ණත්වයේදී ඝන, ද්රව හා වායු යන සියලු අවස්ථාවල පවතින සංයෝග ඇත.
- පහල ද්රවංක හා තාපාංක ඇත.
මේවායේ අණු අතර ප්රබල ආකර්ෂණ බල නැත. එමනිසා අණු වෙන්කිරීමට එතරම් ඉහල ශක්තියක් ලබාදිය යුතු නොවේ. නමුත් ඇතැම් සහසංයුජ ප්රබේද පරමාණුක ජාල ලෙස පවතී. එම ජාල බිදීමට නම් ඉහල ශක්තියක් අවශ්ය වන බැවින් එම ප්රබේද වල තාපාංක හා ද්රවාංක ඉහල වේ.
උදා – දියමන්ති , මිනිරන්.
- විද්යුත් සන්නායක නොවේ.
නිදහස් සචල ඉලෙක්ට්රෝන නොමැති නිසා විද්යුත් සන්නායක නොවේ.
- සහසංයුජ සංයෝග බොහෝමයක් ජලය, ඇමෝනියා වැනි ද්රාවක වල දිය නොවේ. නමුත් CCL4, CHCL3 වැනි කාබනික ද්රාවක වල දිය වේ.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



