විද්යුත් සෘණතාවය අසමාන පරමාණු 2ක් අතර සහසංයුජ බන්ධන සැදීමේදි විද්යුත් සෘණතාවය් වැඩි පරමාණුව මඟින් බන්ධන ඉලෙක්ට්රෝන යුගලය තමා දෙසට ආකර්ෂණය කරගනි.එවිට සෑදෙන අණුක කාක්ෂිකය අසමමිතික වේ.
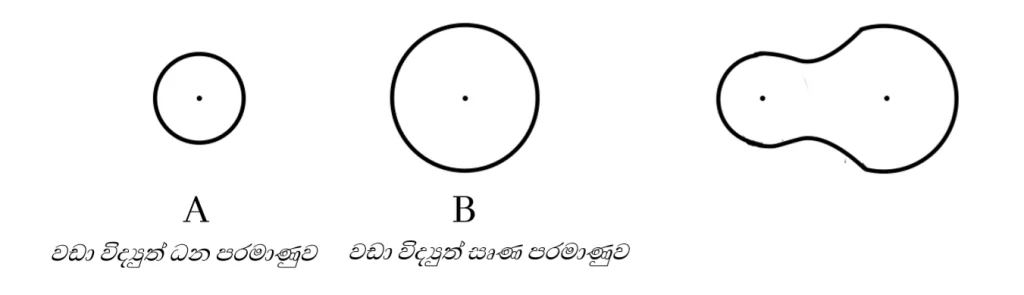
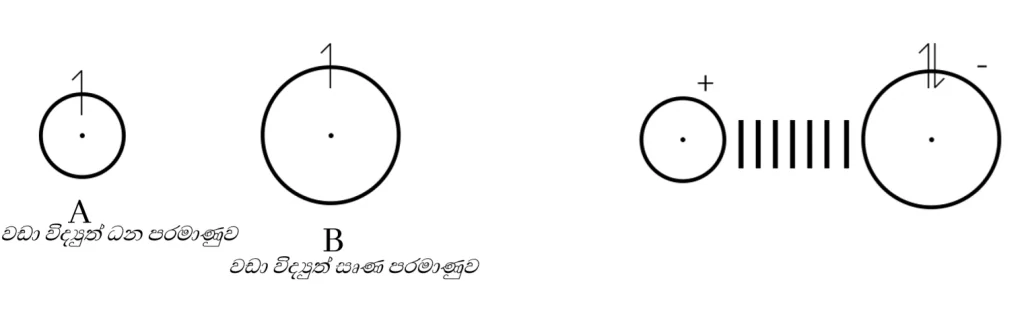
නමුත් ස්ථායිවීම සඳහා විද්යුත්සෘණතා වෙනස ඉතා වැඩි පරමාණු අතර බන්ධන ඉලෙක්ට්රෝන යුගලය මුලුමනින්ම වඩා විද්යුත්සෘණ පරමාණුව දෙසට ආකර්ෂණය වීම නිසා පරමාණු ධන හා සෘණ අයන බවට පත්වේ.
මෙලෙස සෑදෙන ධන හා සෘණ අයන අතර ඇතිවෙන ප්රබල සිථිති විද්යුත් ආකර්ෂණ බලය අයනික බන්ධනය ලෙස හඳුන්වයි.
එක් අයනික බන්ධනයක් හෝ පවතින සංයෝග අයනික සංයෝග ලෙස හැඳින්වේ.
S ගොනුවේ මූලද්රව්ය වලින් Be හැර සෙසු මූලද්රව්ය සාදන සංයෝග සියල්ල අයනික වේ.Be සාදන ඇතැම් සංයෝග අයනික වේ.
අයනික සංයෝග වල ධන හා සෘණ යන ඝන (ස්ඵටික) අවස්ථාවේදී යන දලිසක් ලෙස පවතී.එනම් සෑම ධන අයනයක් වටාම සෘණ අයනද සෘණ අයනයක් වටාම ධන අයනද ලෙස ප්රබල ව්යුහයක් සාදයි.
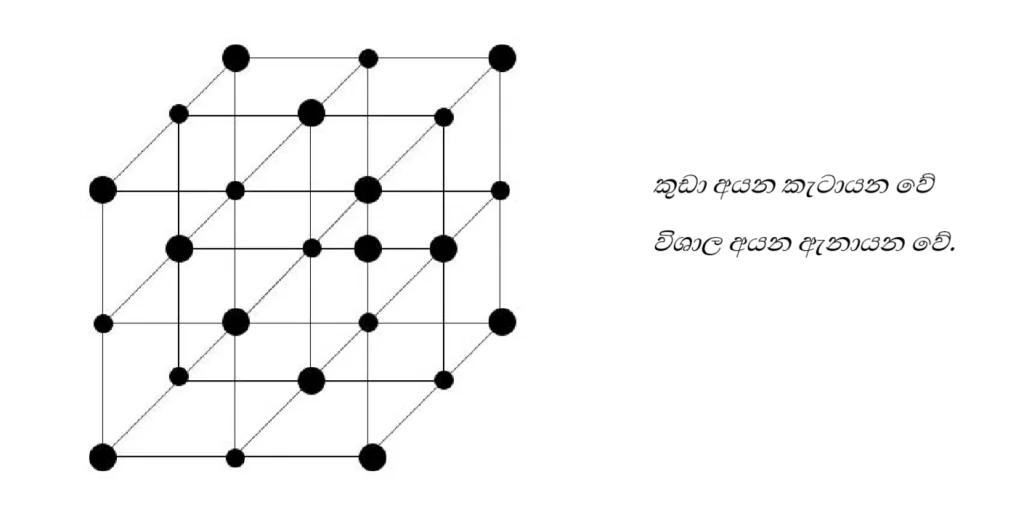
අයනික සංයෝග වල ලක්ෂණ
- කාමර උෂ්ණත්වයේදී අයනික සංයෝග භංගුර ස්ඵටිකරුපි ඝන (දැලිස්) ලෙස පවතී.
- ඉතා ඉහල ද්රවාංක දරයි.
- ඝන තත්වයේදී විද්යුතය සන්නයනය නොකරන අතර ජලීය හෝ විලීන ද්රාවණ වල විද්යුතය සන්නයනය කරයි.
- ජලය වැනි ධ්රැවීය ද්රාවක තුල සුළුවශයෙන් හෝ සම්පුර්ණයෙන් ද්රවණය වන අතර CCL4 වැනි නිර්ධ්රැවීය ද්රාවක වල දිය නොවේ.
- අයනික බන්ධනයක් ඇතිවීම සඳහා පරමාණු දෙක අතර විද්යුත් සෘණතා වෙනස 2.1 ට වඩා වැඩිවිය යුතුයි.
- එම නිසා වෙනස වැඩිවන විට ඒවායේ අයනික ලක්ෂණ වැඩිවේ. සහසංයුජ ලක්ෂණ අඩුවේ.
- අයනික බන්ධන ලෝහයක් හා අලෝහයක් අතර හෝ අලෝහයක් අලෝහයක් අතරද ඇතිවිය හැක. නමුත් ලෝහ ලෝහ අතර ඇති නොවේ.
- අයනික බන්ධනයක් සෑදීමේදී සෘණ අයනය සැමවිටම උච්චවායු වින්යාසය ලබාගනී. නමුත් කැටායනය S ගොනුවේ නම් උච්චවායු වින්යාසය ද P හෝ D ගොනුවේ නම් වඩා ස්ථායි වින්යාසයක් ලබාගනී.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.



