විකිරණශීලතාව
විකිරණශීලතාව මුලින්ම අධ්යනය කලේ හෙන්රි බෙකරල් විසිනි.
න්යෂ්ටියේ ස්ථායිතාව උදෙසා අස්ථායි න්යෂ්ටි හෝ අංශු විසින් ස්වයංසිද්ධව විකිරණ පිටකිරීම මෙසේ හැදින්වේ.
විකිරණශීලි මුලද්රව්ය වලින් විමෝචනය වන කිරණ වර්ග විද්යුත් හා චුම්බක ක්ෂේත්ර වලදි දක්වන හැසිරීම අනුව කිරණ වර්ග තුනකි.
1.ඇල්ෆා අංශු
2.බීටා අංශු
3.ගැමා කිරණ
මෙම කිරණ වර්ග 3 අර්නස්ට් රදර්ෆර්ඩ් විසින් හඳුන්වා දෙන ලදි.
විකිරණශීලතාව ස්වභාවික න්යෂ්ටි තුල සිදුවන සසම්භාවී ක්රියාවක් නිසා බාහිර සාධක මගින් පාලනය කළ නොහැක.එය විකිරණශීලී මූලද්රව්යයේ අඩංගු වන රසායනික සංයෝග මත හෝ උෂ්ණත්වය මත රදා නොපවතී.
| ඇල්ෆා | බීටා | ගැමා | |
| ස්වභාවය | හීලියම් න්යෂ්ටි වේ | අධිවේගී ඉලෙක්ට්රෝන | ඉහල ශක්තියෙන් යුතු විද්යුත් චුම්බක විකිරණ |
| සාපේක්ෂ අරෝපණය | +2 | -1 | 0 |
| ආරෝපණය | 3.2×10 -19 C | 1.602×10 -19 C | 0 |
| ස්කන්ධය | 6.6930×10 -27 kg | 9.107×10 -31 kg | 0 |
| සාපේක්ෂ වායු අයනීකාරක බලය | 105 | 102 | 1 |
| විනිවිද යාමේ හැකියාව | 1 | 102 | 105 |
| ප්රවේගය | 0.5C – 0.7C | 0.25C – 0.99C | අලෝකයේ ප්රවේගය(C) = 3×108 ms-1 |
| ගමන් කරනු ලබන ද්රව්යය |
වාතය හෝ කඩදාසි නමුත් 0.1mm ඇලුමිනියම් තහඩු හරහා ගමන් කරයි.මාතෘ න්යෂ්ටියක් අංශුවක් පිටකල විට කළවිට සෑදෙන දුහිතෘ න්යෂ්ටියේ p ගණන හා n ගණන 2 බැගින් අඩුවේ.එමනිසා ආවර්තිතා වගුවේ ස්ථාන දෙකක් වමට ගමන් කරයි. {}_{\mathrm Z}^{\mathrm A}\mathrm X\;\rightarrow\;{}_2^4\mathrm\alpha\;+\;{}_{\mathrm Z+1}^{\mathrm A-4}\mathrm Y
|
තුනී ඇලුමිනියම් තහඩු මාතෘ න්යෂ්ටියක් බීටා අංශුවක් පිටකල විට ප්රෝටෝන ගණනට එකක් එකතුවන අතර ආවර්තිතා වගුවේ එක් ස්ථානයක් දකුණට ගමන් කරයි. {}_{\mathrm Z}^{\mathrm A}\mathrm X\;\rightarrow{}_{-1}^0\mathrm\beta+\;{}_{\mathrm Z+1}^{\mathrm A}\mathrm Y | ඝනකම් ලෙඩ් තහඩු A හෝ Z අගය වෙනස් නොවන නමුත් ශක්තිය වෙනස් වේ. |
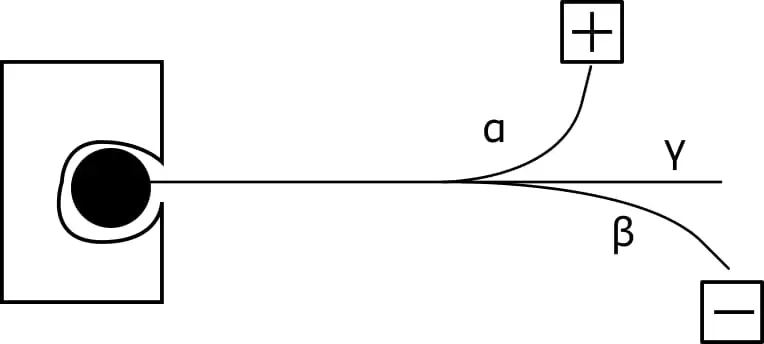
විද්යුත් හෝ චුම්බක ක්ෂේත්රයක් මගින් විකිරණශීලී මුලද්රව්ය වලින් පිටවන විකිරණ හදුනාගැනීම,
විද්යුත් ක්ෂේත්රයකදී,
චුම්බක ක්ෂේත්රයකදී,
කඩදාසියේ තලයට ලම්බක දිශාවක් ඔස්සේ කඩදාසිය තුලට යොමුවූ චුම්බක ක්ෂේත්රයක් ඇතිවිට ෆ්ලෙමිංගේ සුරත් නීතිය අනුව ඍණ ආරෝපිත බීටා අංශු දකුණු අත දෙසටත් ධන ආරෝපිත ඇල්ෆා අංශු වම් අත දෙසටත් ගමන් කරයි.

නියුක්ලයිඩ
නියුට්රෝන අංකය හා ප්රෝටෝන අංකය විශේෂිතව සදහන් කල පරමාණුක ප්රභේද වේ.මෙය නිශ්චිත ප්රෝටෝන සංඛ්යාවක් හා නියුට්රෝන සංඛ්යාවක් ඇති අයනයක්,න්යෂ්ටියක් හෝ සංයෝජනය වූ පරමාණුවක් විය හැකිය.
නියුක්ලයිඩ 1420ක් පමණ දැනට සොයාගෙන ඇත.
න්යෂ්ටිය තුළ හමුවන අංශු නියුක්ලියෝන නම් වේ.
ප්රෝටෝන හා නියුට්රෝන නියුක්ලියෝන වල සංරචක වේ.
නියුක්ලයිඩ වර්ග කිරීම
1.ස්වභාවිකව පවතින ස්ථායි නියුක්ලයිඩ
2.ස්වභාවිකව පවතින අස්ථායි නියුක්ලයිඩ
3.කෘතීම විකිරණශීලි නියුක්ලයිඩ
සමස්ථානික
එකම පරමාණුක ක්රමාංකයක් සහිත වෙනස් ස්කන්ධ ක්රමාංක ඇත්තා වූ පරමාණු එම මූලද්රව්යයේ සමස්ථානික ලෙස හදුන්වයි.
උදා :- හයිඩ්රජන්,
ප්රෝටියම් {}_1^1\mathrm H
ඩියුටීරියම් {}_1^2\mathrm H
ට්රිටියම් {}_1^3\mathrm H
ඔක්සිජන් {}_8^{16}\mathrm O\;,\;{}_8^{17}\mathrm O\;,\;{}_8^{18}\mathrm O
ජේ. ජේ. තොම්සන් හා ෆ්රැන්සිස් විලියම් ඇස්ටන් නිපද වු ස්කන්ධ භේද මානය මුල්ම වරට සමස්ථානික සොයා ගැනීම සඳහා භාවිතා කරන ලදී.
දැනට සොයාගෙන ඇති මූලද්රව්ය අතරින් 87ක් පමණ සමස්ථානික දරන අතර ඒවා නිශ්චිත සංයුතියෙන් යුත් සමස්ථානික මිශ්රනයක් ලෙස පවතී.සමහර මූලද්රව්ය ස්වභාවික සමස්ථානික නොසාදයි.
උදා:- සෝඩියම්,ෆ්ලෝරීන්
මූලද්රව්යයක ස්වභාවයෙන් ස්ථායී වන සමස්ථානික ස්ථායි සමස්ථානික ලෙස ද . ස්ථායී නොවන සමස්ථානික විකිරණශීලී සමස්ථානික ලෙස ද හඳුන්වයි.
සමස්ථානික වල ලක්ෂණ
1.පරමානුක ක්රමාංකය සමාන වූවද ස්කන්ධ ක්රමාංකය එකිනෙක වෙනස් ( එනම් එකම මූලද්රව්යයේ සමස්ථානික වල p හා e සමාන වුවද n වෙනස්)
2.මූලද්රව්යයක රසායනික ලක්ෂණ තීරණය කරනුයේ ඉලෙක්ට්රෝන වින්යාසය මගින් බැවින් සමස්ථානික වල රසායනික ලක්ෂන සමානයි.
3.සමහර සමස්ථානික ස්වභාවිකව පවතින අතර සමහර ඒවා කෘතීමව නිපදවා ඇත.
4.සමහර ඒවා විකිරණශීලීය.
5.සමස්ථානිකවල සාපේක්ෂ පරමාණුක ස්කන්ධය වෙනස් බැවින් භෞතික ලක්ෂන වෙනස් වේ.
සමස්ථානික සහිත මූලද්රව්යයක සා.ප.ස්.සෙවීම
- X නම් මුලද්රව්යයක පවතින සමස්ථානික සහ ඒවායේ සුලභතාවය පහත දී ඇත.X මූලද්රව්යයේ මධ්යන්ය සා.ප.ස්. ගණනය කරන්න.
25 X 26 X 2 X
සුලභතාවය 20% 30% 50%
මධ්යන්ය සා.ප.ස් = (25×20 + 26×30 + 27×50 ) / 100 = 26.3
- මධ්යක පරමාණුක ස්කන්ධය = ∑ ( සමස්ථානික ස්කන්ධය )󠇣 Χ ( භාගික සමස්ථානික සුලභතාව)
- සාපේක්ෂ පරමාණුක ස්කන්ධයේ මධ්යන්ය = 1/ 100 ( A1 × P1 + A2 × P2 ……)
මෙහි A යනු සමස්තානික වල සාපේක්ෂ පරමාණුක ස්කන්ධය වන අතර P යනු සාපේක්ෂ සුලබතා වේ.
- ස්වභාවිකව පවතින කාබන්හි 612 C සමස්ථානිකය 98.89% ද 136 C 1.11% ද ඇත.136C හි සාපේක්ෂ පරමාණුක ස්කන්ධය 13.003 නම් ස්වභාවිකව පවතින මධ්යන්ය සාපේක්ෂ පරමාණුක ස්කන්ධය සොයන්න.
12 6 C 136 C
සුලබතාවය 98.89% 1.11%
සා.ප.ස්. 12 13.003
සා.ප.ස්. මධ්යන්ය = (12× 98.89 + 13.003× 1.11) / 100
=12.001
සාපේක්ෂව සමස්ථානික ස්කන්ධය, හරියටම ස්කන්ධ ක්රමාංකයට සමාන වනුයේ 126 C වේ.
සමස්ථානික පවතින බවට සාක්ෂි
1.සාපේක්ෂ පරමාණුක ස්කන්ධයේ අයන පූර්ණ සංඛ්යාවලින් ඈත්වීම.
2.ස්කන්ධ භේද දර්ශකයෙන් හා ධන කිරණ විශ්ලේෂනයෙන් ලැබෙන සාක්ෂි.
3.විකිරණශීලී මූලද්රව්ය සාම්පලයකින් එකිනෙකට වෙනස් ස්කන්ධ ක්රමාංක සහිත සමස්ථානික සොයාගත හැකිවීම.
උදා:- යුරේනියම්
233U , 235U , 238U

