පරමාණුවක සංයුජතා කවචයේ කාක්ෂික දෙකක් හෝ කිහිපයක් මිශ්ර වී ශක්තියෙන් හැඩයෙන් සහ විශාලත්වයෙන් සමාන නව කාක්ෂික සමූහයක් සෑදීමේ ක්රියාවලිය මුහුම්කරණය නම් වේ.
මුහුම්කරණය පැහැදිලි කර ගැනීමට C වල මුහුම්කරණය සලකමු.
- C – 1s2 2s2 2p2
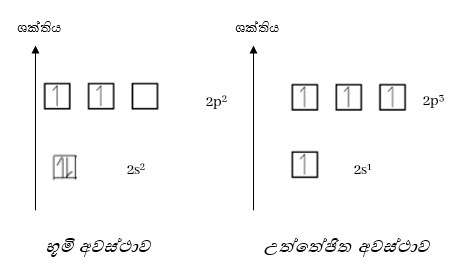
උත්තේජිත අවස්ථාවේදී අවසාන ශක්ති මට්ටමේ s කක්ෂිකයේ හා p කාක්ෂික 3 හි ඉලෙක්ට්රෝනය බැඟින් පවතී.
නමුත් මෙම s කක්ෂිකය p කාක්ෂික 3 සමඟ එක්වී ශක්තියෙන් හා හැඩයෙන් සමාන මුහුම් කාක්ෂික 4 ක් සාදයි. මෙය මුහුම්කරණය නම් වේ.
එකිනෙකට වෙනස් මුහුම්කරණ ගණනාවක් ඇතිවිය හැක.
- sp මුහුම්කරණය
- sp2 මුහුම්කරණය
- sp3 මුහුම්කරණය
- sp3d1 මුහුම්කරණය
- sp3 d2 මුහුම්කරණය
මෙහිදී s කාක්ෂික ස p කාක්ෂික අතර මුහුම්කරණ පමණක් සලකා බැලේ.
පරමාණුවක මුහුම්කරණය වටහා ගැනීමට පහත දැක්වෙන කරුණු වැදගත් වේ.
- හුදකලා පරමාණුවකට මුහුම්කරණය නැමැති සංකල්පය යොදන්නේ නැත. යම් අණුවක ඇති පරමාණුවක් මගින් බන්ධන සෑදීම විස්තර කිරීමට මුහුම්කරණය යොදා ගනු ලැබේ.
2. මෙහිදී හැඩයෙන් හා ශක්තියෙන් සමාන නොවන වෙනස් උපශක්ති මට්ටම්වලට අයත් කාක්ෂික දෙකක් අවම වශයෙන් මිශ්ර විය යුතුය.
නිදසුන්: s කාක්ෂිකය සමග එම පරමාණුවේ p කක්ෂිකයන් හෝ p කාක්ෂික කිහිපයක් (3ක් දකවා)මුහුම්කරණයට සහභාගී වේ. මේ නිසා මුහුම් කාක්ෂික වලට පිරිසිදු අනන්යතාවක් නොමැත. එබැවින් මුහුම් කාක්ෂිකවල හැඩය මුහුම්කරණයට සහභාගි වන කාක්ෂිකවල හැඩයට වඩා වෙනස් ය.
3. මුහුම්කරණයට සහභාගි වූ පරමාණුක කාක්ෂික ගණනට සමාන මුහුම් කාක්ෂික සංඛ්යාවක් ප්රතිඵල ලෙස සැදේ. මුහුම්කරණයට සහභාගි වන කාක්ෂිකවල ශක්ති මට්ටම් වෙනස් වුව ද සෑදෙන මුහුම් කාක්ෂික එකම ශක්ති මට්ටමක පිහිටයි. s හා p පරමාණුක කාක්ෂික මුහුම්කරණය නිසා ප්රතිඵල ලෙස සෑදුණු මුහුම් කාක්ෂික හැඩයෙන් හා ශක්තියෙන් සමාන ය. එහෙත් ඒවා ත්රිමාන අවකාශයේ දිශානත වී ඇති ආකාරයෙන් වෙනස් වේ.
4. බන්ධන ඇතිවීම සඳහා කිසියම් පරමාණුවක මුහුම් කාක්ෂිකයක් වෙනත් පරමාණුවකට අයත් මුහුම් කාක්ෂිකයක් සමග හෝ වෙනත් පරමාණුවහ මුහුම් කාක්ෂිකයක් සමග අතිච්ඡදනය වේ.
sp3 මුහුම්කරණය
බන්ධන සෑදීමේදී පරමාණුවක අවසාන ශක්ති මට්ටමේ ඇති s කක්ෂිකය එම ශක්ති මට්ටමේම ඇති p කාක්ෂික 3 සමඟ මිශ්ර වී sp3 මුහුම් කාක්ෂික 4ක් සෑදීමේ ක්රියාවලියයි.
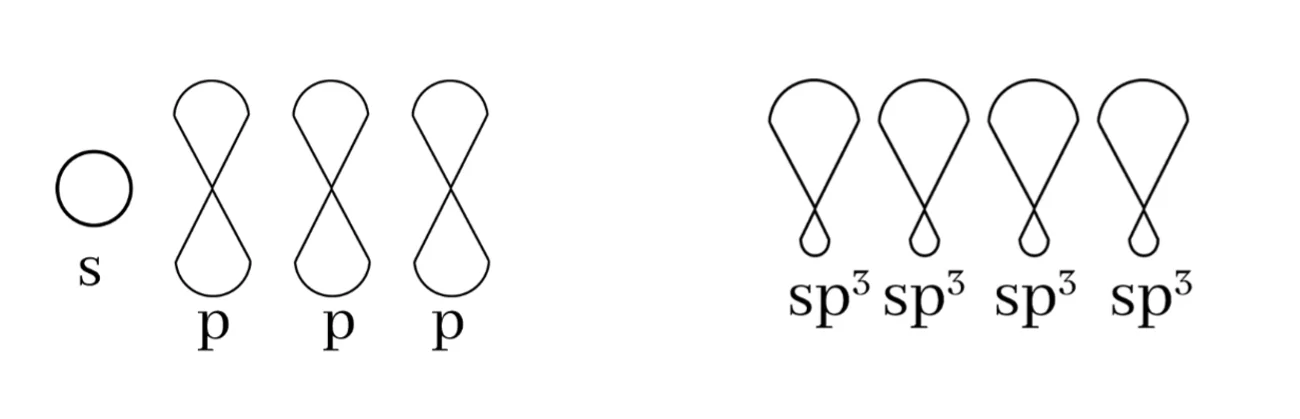
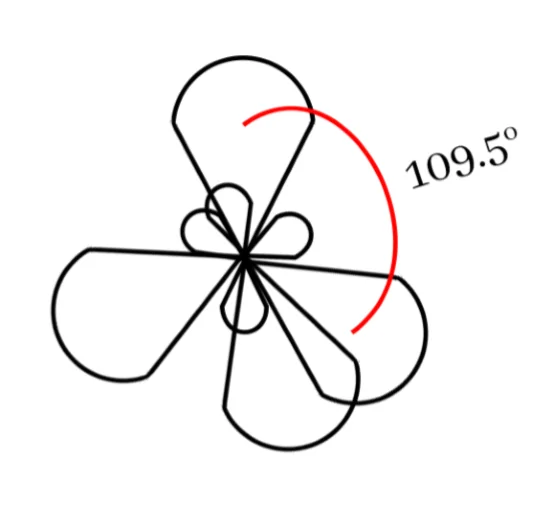
මෙම sp3 මුහුම් කාක්ෂික 4 පරමාණුවේ න්යෂ්ටිය වටා චතුස්තලිය හැඩයක් ලැබෙන සේ පිහිටයි. මෙය සමමිතික නම් කාක්ෂික 2 ක් අතර කෝණය 109.5o ක් වේ.
C හි sp3 මුහුම්කරණය
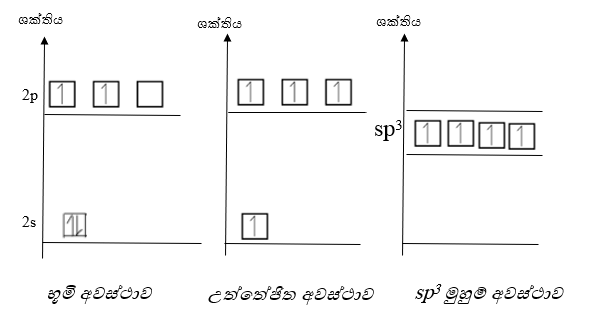
- උත්තේජිත C පරමාණුවක 2s කාක්ෂිකය සහ 2p කාක්ෂික 3 මිශ්ර වී ශක්තියෙන් සහ හැඩයෙන් සමාන නව කාක්ෂික 4 ක් සෑදීමේ ක්රියාවලියයි.
- අවස්ථාවේ උත්තේජිත අවස්ථාවේ සහ sp3 මුහුම් අවස්ථාවේ පවතින C පරමාණුවේ සංයුජතා කවචයේ ශක්ති සටහන පහත පරිදිය.
sp2 මුහුම්කරණය
බන්ධන සෑදීමේදී පරමාණුවක අවසාන ශක්ති මට්ටමේ ඇති s කක්ෂිකය එම ශක්ති මට්ටමේම ඇති p කාක්ෂික 2 සමඟ මිශ්ර වී sp2 මුහුම් කාක්ෂික 3ක් සෑදීමේ ක්රියාවලියයි.
මෙහිදී මුහුම්කරණයට ලක් නොවූ p කක්ෂිකයක් ඉතුරු වේ. එය නුමුහුම් p කක්ෂිකය ලෙස හඳුන්වයි.
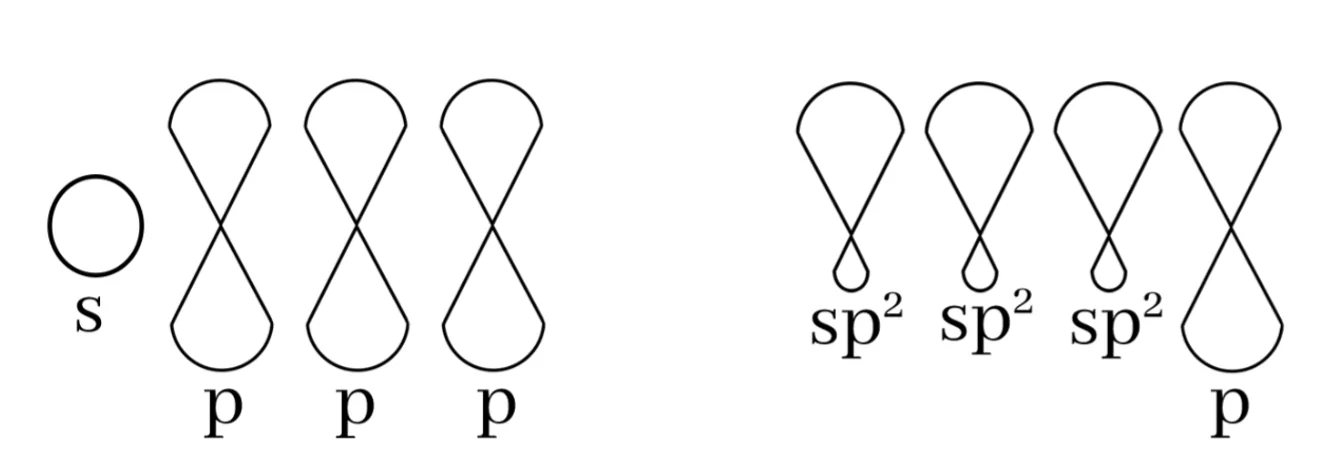
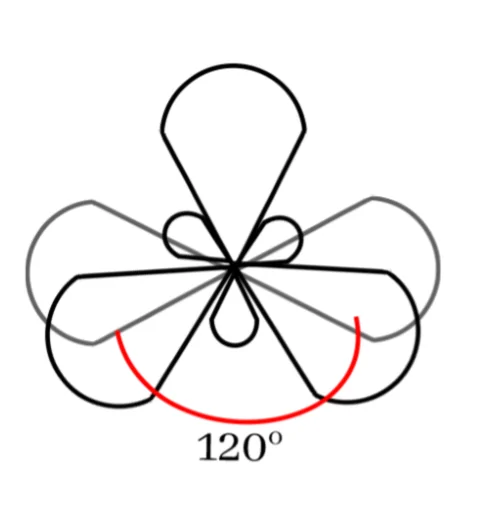
මෙම sp2 මුහුම් කාක්ෂික 3 පරමාණුවේ න්යෂ්ටිය වටා තලීය ත්රිකෝණාකාර හැඩයක් ලැබෙන සේ පිහිටයි. මෙය සමමිතික නම් කාක්ෂික 2 ක් අතර කෝණය 120o ක් වේ.
නුමුහුම් P කාක්ෂිකය එම තලයට ලම්භකව පිහිටයි.
C හි sp2 මුහුම්කරණය
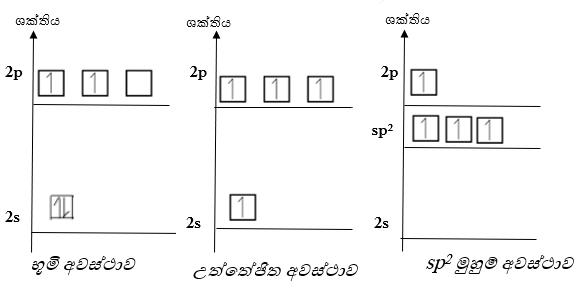
උත්තේජිත පරමාණුවක 2S කාක්ෂිකය සහ 2P කාක්ෂික මිශ්ර වී ශක්තියෙන් සහ හැඩයෙන් සමාන නව කාක්ෂීක 3 ක් සැදීමේ ක්රියාවලියයි. භූමි අවස්ථාවේ උත්තේජිත අවස්ථාවේ සහ sp2 මුහුම් අවස්ථාවේ පවතින C පරමාණුවේ සංයුජතා කවචයේ ශක්ති සටහන පහත පරිදිය.
sp මුහුම්කරණය
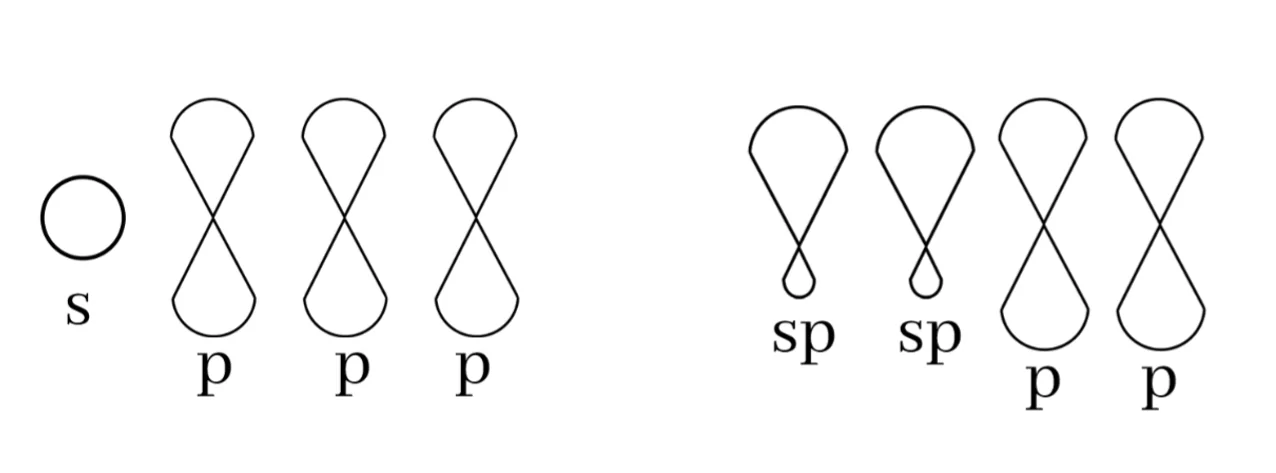
බන්ධන සෑදීමේදී පරමාණුවක අවසාන ශක්ති මට්ටමේ ඇති s කක්ෂිකය එම ශක්ති මට්ටමේම ඇති p කාක්ෂිකයක් සමඟ මිශ්ර වී sp මුහුම් කාක්ෂික 2ක් සෑදීමේ ක්රියාවලියයි.
මෙහිදී මුහුම්කරණයට ලක් නොවූ නුමුහුම් p කාක්ෂික 2ක් ඇත.
මෙම sp මුහුම් කාක්ෂික 2 පරමාණුවේ න්යෂ්ටිය වටා රේඛිය හැඩයක් ලැබෙන සේ පිහිටයි. මේ අතර කෝණය 180o ක් වේ.
නුමුහුම් p කාක්ෂික 2 එකිනෙකටත් එම රේඛාවටත් ලම්භකව පිහිටයි
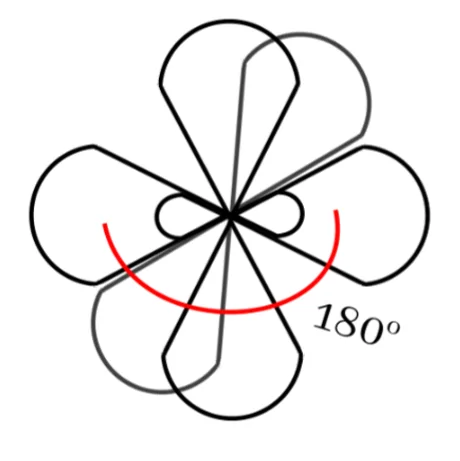
C හි sp මුහුම්කරණය
උත්තේජිත C පරමාණුවක 2S කාක්ෂිකය සහ 2P කාක්ෂිකයක් මිශ්ර වී ශක්තියෙන් සහ හැඩයෙන් සමාන නව කාක්ෂික 2 ක් සෑදීමේ ක්රියාවලියයි.
භූමි අවස්ථාවේ උත්තේජිත අවස්ථාවේ සහ sp මුහුම් අවස්ථාවේ පවතින සංයුප්ත කවචයේ ශක්ති සටහන පහත පරිදිය.
![]()
- මුහුම්කරණය සිදුවන්නේ මධ්ය පරමාණුවල පමණක් යයි සැලකේ. අග්රස්ථ පරමාණුවල මුහුම්කරණයක් සිදු වන බවට සාක්ෂි නොමැත.
- මාධ්ය පරමාණුව,
- ඒක බන්ධන පමණක් සාදයි නම් sp3 ද,
- ද්විත්ව බන්ධනයක් සාදයි නම් sp2 ද,
- ත්රිත්ව බන්ධනක් සාදයි නම් sp ද,
- ද්විත්ව බන්ධන 2ක් සාදයි නම් sp ද, ලෙස මුහුම්කරණයට ලක් වේ.
ද්විත්ව හා ත්රිත්ව බන්ධන ඇතිවීම.
- පරමාණු දෙකක් අතර,
- ඒක බන්ධනයක් නම් එය සිග්මා බන්ධනයකි
- ද්විත්ව බන්ධනයක් නම් එකක් සිග්මා ද අනෙක පයි බන්ධනයක් ද වේ.
- ත්රිත්ව බන්ධනයක් නම් එකක් සිග්මා ද අනෙක් බන්ධන දෙක පයි බන්ධන ද වේ.
- සිග්මා බන්ධන ඇතිවන්නේ මුහුම් කාක්ෂික 2ක් අතර රේඛිය අතිච්ඡාදනයෙනි.
- පයි බන්ධන ඇතිවන්නේ නුමුහුම් කාක්ෂික 2ක් අතර පාර්ශ්වික අතිච්ඡාදනයෙනි. මෙයට මුහුම් කාක්ෂික බලපාන්නේ නැත.
C2H4 හි ද්විත්ව බන්ධනය ඇතිවන ආකාරය බලමු.
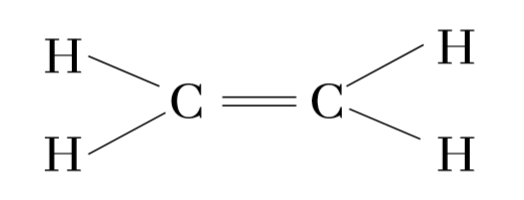
එමනිසා රේඛීය අතිච්ඡාදනයේදී එකම රේඛාවේ පිහිටි මුහුම් කාක්ෂික 2ක් අතිච්ඡාදනය වන අතර,
පාර්ශ්වික අතිච්ඡාදනයේදී එකිනෙකට සමාන්තර නුමුහුම් p කාක්ෂික 2ක් අතිච්ඡාදනය වේ.
ත්රිත්ව බන්ධන නිර්මාණය වන ආකාරය අධ්යයනය සදහා නිදසුන් ලෙස එතයින්හි කාබන් පරමාණු දෙක අතර වූ ත්රිත්ව බන්ධනය නිර්මාණය වන ආකාරය සලකමු. කාබන් පරමාණු දෙක අතර වූ ත්රිත්ව බන්ධනයේ සංයුතිය අනුව එක් බන්ධනයක් \mathrm\sigma බන්ධනයකි. ඉතිරි බන්ධතා දෙක, \mathrm\pi බන්ධන දෙකකි. එතයින් වල ලුවිස් ව්යුහය පහත දැක්වේ.
![]()
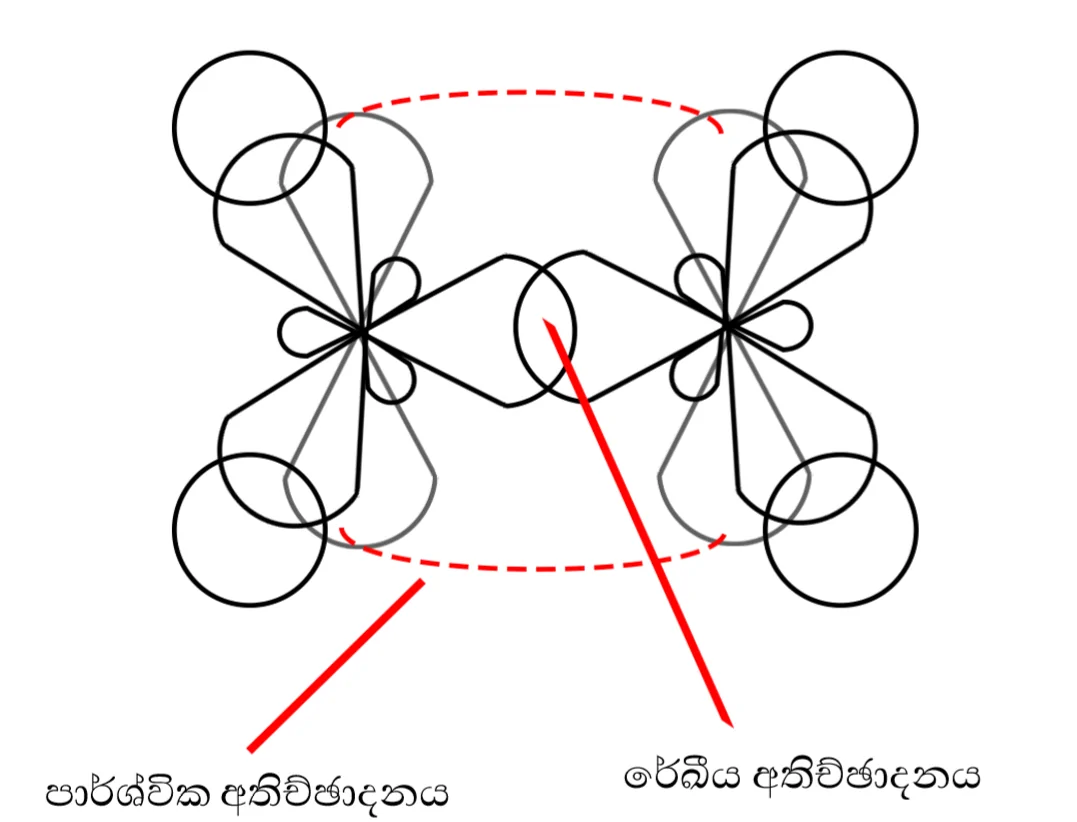
එතයින්හි එක් කාබන් පරමාණුවක් බන්ධන දෙකක් (C-C හා C-H) බැගින් සාදයි. මේ නිසා කාබන් පරමාණු sp මුහුම්කරණයේ ඇති අතර පරමාණු දෙකෙහි p පාක්ෂික දෙකෙහි අක්ෂ එකිනෙකට සමාන්තර වන පරිදි පිහිටයි. එය පහත රූපයෙන් දක්වා ඇත.
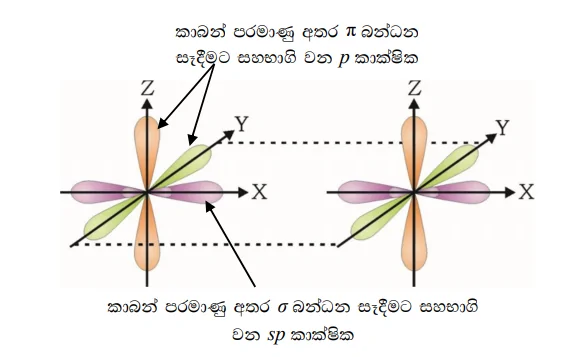
- py කාක්ෂික අක්ෂ දෙක සමාන්තරව පිහිටයි.
- px පාක්ෂික අක්ෂ දෙක සමාන්තරව පිහිටයි.
- x අක්ෂය මත එකිනෙකට මුහුණලා ඇති මුහුම sp කාක්ෂික දෙක කාබන් පරමාණු දෙක අතර 7 බන්ධනයක් සාදයි.
එක් \mathrm\pi බන්ධනයක් සෑදීමට සහභාගි වන p කාක්ෂික අක්ෂ දෙක එකිනෙකට සමාන්තර අතර එම අක්ෂයන් දෙවන \mathrm\pi බන්ධනය සාදන p කාක්ෂික අක්ෂවලට ලම්බක වේ. ත්රිත්ව බන්ධනයේ වූ \mathrm\pi කාක්ෂික ඉලෙක්ට්රෝන ව්යාප්තිය සඳහා වූ මනඃකල්පිත තල එකිනෙකට ලම්බක වේ.
පහත දී ඇති රූප සටහන් sp3, sp2 හා sp මුහුම් කාක්ෂික වල හැඩය හා s හා p කාක්ෂික ගුණ ප්රතිශතය සංසන්දනය කෙරේ.

අණුවල ධ්රැවියතාව සඳහා විද්යුත් සෘණතා හා ජ්යාමිතියේ බලපෑම
බන්ධන සාදන පරමාණු 2හි විද්යුත් සෘණතා වෙනස විශාල නම් එම බන්ධන ඉලෙක්ට්රෝන වලාව ධ්රැවීකරණය වී ඇතැයි සලකනු ලැබේ. බන්ධන ධ්රැවීය විටදී, සහසංයුජ බන්ධනය සාදා ඇති ඉලෙක්ට්රෝන වැඩිපුර ගැවසෙන්නේ විද්යුත් සෘණතාවය වැඩි පරමාණුව ආශ්රිතවයි.
බන්ධනයක් ධ්රැවීය වනුයේ පරමාණු 2ක් අතර ඇති විද්යුත් සෘණතා වෙනස නිසාය.
විද්යුත් සෘණතා වෙනස විශාල නම් ධ්රැවියතාවය විශාලය.
නමුත් සමස්ත අණුව ධ්රැවීය වීම කෙරේ එම අණුවේ ජ්යාමිතිය මඟින්ද බලපෑමක් ඇත.
උදා – C – O බන්ධනය ධ්රැවියයි.නමුත් CO2 අණුව නිර්ධ්රැවියයි.
හේතුව – CO2 අනුව සමමිතික හා රේඛිය වීමයි.
C – Cl බන්ධනය ධ්රැවියයි. නමුත් CCl4 නිර්ධ්රැවීය අණුවකි.
හේතුව – CCl4 අණුව සමමිතික හා චතුස්තලිය වීමයි.
එකම මුලද්රව්යයේ ද්විපරමාණුක අණු සරල නිර්ධ්රැවීය අණු සඳහා නිදසුන්ය.
ද්විධ්රැව ඝූර්ණය
එකිනෙක රසායනිකව බන්ධනය වී ඇති පරමාණු 2 ක් අතර ඇතිවන විද්ය්ත් සෘණතාවය හේතුකොටගෙන / වෙනක් බාහිර බලපෑමක් හේතුවෙන් හෝ බන්ධනයට සම්බන්ධ පරමාණුවල ඉලෙක්ට්රෝන වලා අසමමිතිකව ව්යාප්ත විය හැක.
මෙය අණුවෙහි ධ්රැවීකරණයක් ලෙස හඳුන්වයි.
මෙහිදී විද්යුත් සෘණතා වෙනසට අනුව සිදුවූයේ නම් හටගන්නා අණුව ස්ථීර ද්විධ්රැවයක් ලෙසද, බාහිර බලපෑමක් නිසා ඇතිවූයේ නම් ප්රේරිත ද්වීධ්රැවයක් ලෙසද හඳුන්වයි.
මෙවැනි ද්විධ්රැවයක් එක් ආරෝපණ කේන්ද්රයක ඇති ආරෝපණයේත්, පරමාණු දෙක අතර ඇති බන්ධන දිගේත් ගුණිතය, එහි ද්විධ්රැව ඝූර්ණය ලෙස හඳුන්වයි.
\text{ද්විධ්රැව ඝූර්ණයේ විශාලත්වය}\;(µ)\;=\;\text{ධ්රැවයක ආරෝපණය}\;(\mathrm\delta)\;\mathrm x\;\text{බන්ධන දිග}\;(\mathrm\lambda)
ද්විධ්රැව ඝූර්ණය නිරූපණය කරන්නේ, විද්යුත් සෘණතාවය වැඩි දෙසට ඊතලයක් ඇද විද්යුත් සෘණතාවය අඩු පෙදෙසේ + ආරෝපණයක් දැමීමෙනි.

සමහර අණුවල ධ්රැවීය වූ බන්ධන තිබුණද සමස්ත ද්විධ්රැව ඝූර්ණය වන්නේ එක් එක් බන්ධනයේ ද්විධ්රැව ඝූර්ණයන්ගේ සම්ප්රයුක්තයයි. එවිට සමමිතික අණුවල ද්විධ්රැව ඝූර්ණය ශූන්යක් වේ.
ද්විධ්රැව ඝූර්ණය දෛශික රාශියකි.
ද්විධ්රැව ඝූර්ණය මැනීම සදහා SI ඒකකය ක්ලොම්බ් මීටර්(Cm) වන අතර Debye(D) යලස හදුන්වන ඒකකයක්ද භාවිත කෙරේ. 1D = 3.34 x 10-3 Cm
එකම ත්රිමාණීය හැඩය තිබුණද, මධ්ය පරමාණුව වටා ඇති පරමාණු අනුව ද්විධ්රැව ඝූර්ණයේ ප්රමාණය හා දිශාව තීරණය වේ.
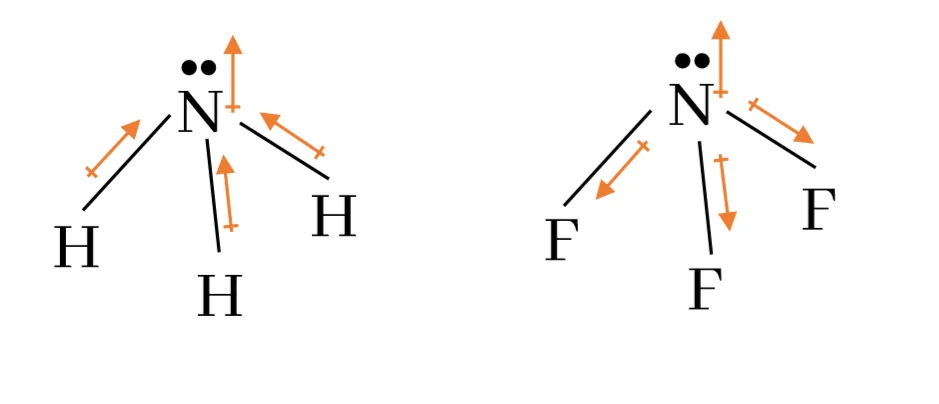
වැදගත් – එකසර ඉලෙක්ට්රෝන ඇති විට ඊතලය එකසර ඉලෙක්ට්රෝන යුගලය දෙසට යොමු කරයි.
විද්යුත් සෘණතාවයේ විශාලත්වය කෙරෙහි බලපාන සාධක
යම් මූලද්රව්යක විද්යුත් සෘණතාවය නියතයක් යැයි උපකල්පනය කළ ද, මූලද්රව්යයේ පරිසරය මත එය තරමක් දුරට වෙනස් වේ.
මුහුම්කරණය
- s කාක්ෂික ප්රමාණයෙන් කුඩායි.
- sp සිට sp3 දක්වා මුහුම් කාක්ෂිකාවල p ලක්ෂණ ක්රමිකව වැඩිවේ. s ලක්ෂණ අඩුවේ.
- එම නිසා ඊට සාපේක්ෂව විශාලත්වයද ක්රමිකව වැඩිවේ.
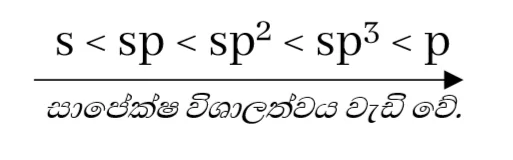
- කාක්ෂික වල සාපෙක්ෂ විශාලත්වය වැඩි වන විට, එම කාක්ෂික අත්ච්ඡාදනයේදී හටගන්නාවූ බන්ධන ඉලෙක්ට්රෝන යුගල න්යෂ්ටියට වඩාත් දුරස්ථ වේ.
- එමනිසා විශාල කාක්ෂිකවල විද්යුත් සෘණතාවය අඩුය.
- ඒ අනුව, s ලක්ෂණ වැඩි වන විට විද්යුත් සෘණතාවය වැඩි වේ
ආරෝපණය
- උදාසීන පරමාණුවකට වඩා + ආරෝපිත පරමාණුවක විද්යුත් සෘණතාවය වැඩිය. (+ ආරෝපණයටද ඉලෙක්ට්රෝන ආකර්ෂණය කරගත හැකි වීම)
- නමුත් (-) ආරෝපිත පරමාණුවකට වඩා උදාසීන පරමාණුවක විද්යුත් සෘණතාවය අඩුය. ( (-) ආරෝපණය මඟින් ඉලෙක්ට්රෝන විකර්ෂණය කරන නිසා)
උදා –
NH2–, NH3, NH4+ හි සියලු N පරමාණුවල මුහුම්කරණය sp3 ය.
නමුත් ඒවායේ විද්යුත් සෘණතාවය, NH2– < NH3 < NH4+ ලෙස වේ.
ඔක්සිකරණ අංකය
- ඔක්සිකරණ අංකයේ + ගතිය වැඩි වන විට විද්යුත් සෘණතාවය වැඩි වේ.
උදා – H2S, SO32-, SO42- ප්රබේද වල S පරමණුවේ මුහුම්කරණය sp3 ද අරෝපණය 0 ද වේ.
මේවායේ මුහුම්කරණය හා අරෝපණය එකම වුවද, ඒවායේ S වල ඔක්සිකරණ අංක පිළිවෙලින් -2, +4, +6 වේ.
එමනිසා ඒවායේ විද්යුත් සෘණතාවය H2S < SO32- < SO42- ලෙස වැඩිවේ.
අණුවේ සලකා බලන පරමාණුවකට සම්බන්ධ අනෙකුත් පරමාණුවල ස්වභාවය
උදා – CF4 වල විද්යුත් සෘණතාවය CCl4 වලට වඩා වැඩිය.
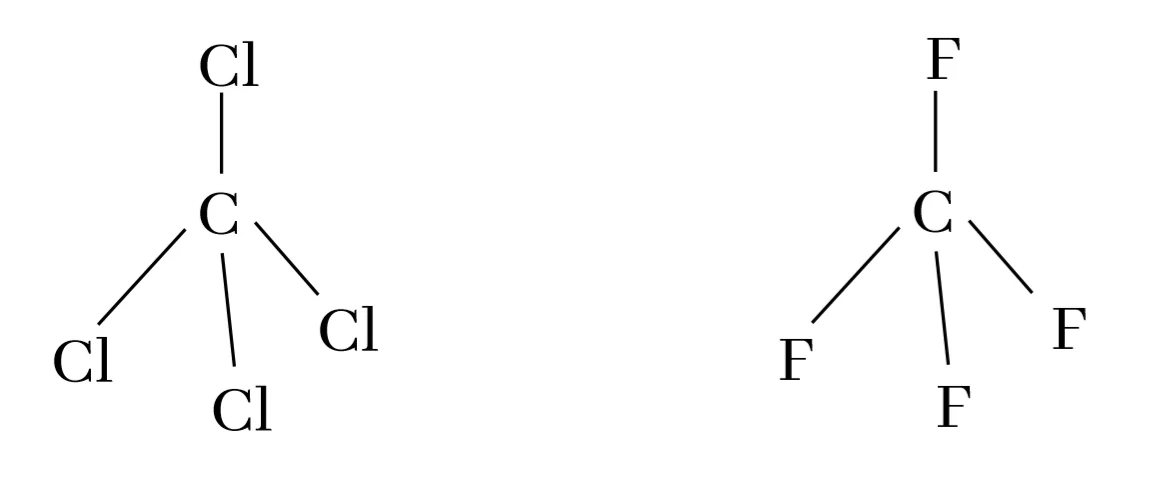
F හි විද්යුත් සෘණතාවය > Cl හි විද්යුත් සෘණතාවය
එනම් F, Cl ට වඩා C හි ඉලෙක්ට්රෝන තමන් දෙසට අදියි.
එවිට CF4 හි C මත ඉලෙක්ට්රෝන ඝනත්වය CCl4 වලදීට වඩා අඩු වේ. ඊට අනුරූපව CF4 හි C වල විද්යුත් සෘණතාවය වැඩිවේ.
සහසංයුජ බන්ධනයක ඇති කිසියම් පරමාණුවක විද්යුත් සෘණතාවයේ විශාලත්වය සංසන්දනයට ඉහත නීති හතර යොදන ප්රමුඛතා පිළිවෙල පහත ලෙස වේ.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

