රසායනික කෝෂ
ධාරාවක් ලබාගත හැකි වන පරිදි අර්ධ කෝෂ 2ක් සම්බන්ධ කිරීමෙන් රසායනික කෝෂයක් ලැබේ.
උදා : Zn හා Cu වලින් සමන්විත කෝෂය සලකමු

- ලවණ සේතුවක් හෝ සවිවර ප්රාචීරය සහිත කෝෂ ද්රව සන්ධියක් සහිත කෝෂ ලෙස හැදින්වේ.
- Cu වලට වඩා Zn වල ඔක්සිකරණය වීමේ හැකියාව වැඩි නිසා Zn මත ඔක්සිකරණය සිදුවී එහි ඉලෙක්ට්රෝඩය මත නිදහස් e වැඩිවේ. ඒවා බාහිර කම්බිය දිගේ Cu ඉලෙක්ට්රෝඩය වෙත ගමන් කරයි. එවිට Cu සිට Zn වෙත ධාරාව ගමන් කරයි.
රසායනික කෝෂයක ඇනෝඩය හා කැතෝඩය
- රසායනික කෝෂයකදී ඔක්සිකරණය වන ඉලෙක්ට්රෝඩය ඇනෝඩයයි.
- සපයා ඇති වි.ගා.බ. අතරින් වැඩි ඍණ වි.ගා.බ. සහිත ඉලෙක්ට්රෝඩය ඇනෝඩයයි.
- රසායනික කෝෂයක ඔක්සිහරණය වන ඉලෙක්ට්රෝඩය කැතෝඩයයි.
- සපයා ඇති වි.ගා.බ. අතරින් වැඩි (+) වි.ගා.බ. සහිත ඉලෙක්ට්රෝඩය කැතෝඩයයි.
උදා: ඇනෝඩය – Zn කැතෝඩය – Cu
රසායනික කෝෂයක ධන ධ්රැවය හා ඍණ ධ්රැවය
- ඉලෙක්ට්රෝඩ වලින් ඉලෙක්ට්රෝන අතිරික්තයක් සහිත ඉලෙක්ට්රෝඩය ඍණ ධ්රැවය වේ.
- ඉලෙක්ට්රෝඩ වලින් ඉලෙක්ට්රෝන ඌනතාවක් සහිත ඉලෙක්ට්රොඩය ධන ධ්රැවීය වේ.
- සපයා ඇති විද්යුත් ගාමක බල අතරින් වැඩි ඍණ වි.ගා.බ. සහිත ඉලෙක්ට්රොඩය ඍණ ධ්රැවීය වේ.
උදා: (-) ධ්රැවය – Zn
(+) ධ්රැවය – Cu
අර්ධ කෝෂ ප්රතික්රියා
- රසායනික කෝෂයෙහි එක් එක් ඉලෙක්ට්රෝඩය මත සිදුවන ප්රතික්රියා අර්ධ කෝෂ ප්රතික්රියා වේ.
- ඉලෙක්ට්රෝඩ සන්නායක කම්බියකින් සම්බන්ධ කර ඇතිනම් කෝෂය ක්රියාත්මක වන නිසා අර්ධ කෝෂ ප්රතික්රියා පූර්ණව සිදුවේ.
ඍණ ධ්රැවයේ (ඇනෝඩයේ) Zn(s) → Zn(aq)2+ + 2e
ධන ධ්රැවයේ (කැතෝඩයේ) Cu(aq)2+ + 2e → Cu(s)
- ඉලෙක්ට්රෝඩ සන්නායක කම්බියකින් සම්බන්ධ කර නොමැතිවිට හෝ කෝෂය විසර්ජනය වි ඇති විට අර්ධ කෝෂ ප්රතික්රිය ප්රත්යාවර්ථ ලෙස දැක්විය යුතුය.
ඍන ධ්රැවයේ (ඇනෝඩයේ) Zn(s) ⇌ Zn(aq)2+ +2e
ධන ධ්රැවයේ (කැතෝඩයේ) Cu(aq)2+ + 2e ⇌ Cu(s)
සම්මත කෝෂය ලිවීම (IUPAC ක්රමයට ලිවීම)
- ඔක්සිකරණ ක්රියාව කෝෂ අංකනයට අදාලව ලියා ඔක්සිහරණ ක්රියාව කෝෂ අංකනයට අදාලව ලියයි.
- මෙහිදී ලවණ සේතුව නිරූපණයට එම ක්රියා 2 අතර සමාන්තර ඉරි 2ක් යොදයි.
Zn (s) | Zn2+(aq,1 moldm-3) || Cu2+(aq,1 moldm-3) | Cu (s)
- සවිවර ප්රාචිරයකින් සම්බන්ධව ඇතිවිට කඩ ඉරක් යොදනු ලැබේ.
Zn (s) | Zn2+(aq,1 moldm-3) Cu2+(aq,1 moldm-3) | Cu (s)
- ද්රව සන්ධියක් නොමැති විට සමාන්තර ඉර හෝ කඩඉරි යෙදිය නොහැක.
- කෝෂයෙහි විද්යුත් ගාමක බලය
- රසායනික කෝෂයක වි.ගා.බ. යනු ධාරාවක් ගලා නොයන විට ඉලෙක්ට්රොඩ දෙක අතර විභව වෙනසයි.
E°(cell) = E°(RHS) + E°(LHS) → (සම්මත වන විට)E(cell) = E(RHS) + E(LHS) → (සම්මත නොවන විට)
- කෝෂය IUPAC ක්රමයට ලියා නැති විට
E°(cell) = E°(c) + E°(a) →(සම්මත වන විට)E(cell) = E(c) + E(a) →(සම්මත නොවන විට)
උදා: Eo(cell) = Eo(c) + Eo(a)
= +0.39V – (-0.76V)
= +1.1V
- රසායනික කෝෂයක වි.ගා.බ. සැම විටම (+) අගයකි.
කෝෂ ප්රතික්රියාව ලිවීම
ඔක්සිකරණ ප්රතික්රියාව හා ඔක්සිහරණ ප්රතික්රියාව ලියා ඒවා සුළු වන ආකාරයට එකතු කෙරේ.
Zn(s) → Zn(aq)2+ + 2e → 1Cu(aq)2+ + 2e → Cu(s) → 21 + 2 →Zn(s) + Cu(aq)2+ → Zn(aq)2+ + Cu(s)
- කෝෂය විසර්ජනය වී ඇතිවිට හෝ සන්නායක කම්බියකින් සම්බන්ධ කර නොමැති විට
Zn(s) + Cu(aq)2+ ⇌ Zn(aq)2+ + Cu(s)
උදා: O2 හා Cl උපයෝගී කරගනිමින් සාදන ලද රසායනික කෝෂය සලකන්න
- දල රූපසටහන
- අර්ධ කෝෂ ප්රතික්රියා ලියන්න
- සම්පුර්ණ කෝෂ ප්රතික්රියාව ලියන්න
- කෝෂය IUPAC ක්රමයට නම් කරන්න
- කෝෂයේ සම්මත වි.ගා.බ. සොයන්න
1.

2.
ඇනෝඩයේ 4OH(aq)– → O2(g) + 2H2O + 4e →(1)
කැතෝඩයේ Cl + 2e → 2Cl(aq)– → (2)
3.
(1) +(2)*2 → 4OH(aq)– + 2Cl2(g) → O2(g) + 2H2O + 4e + 4Cl(aq)–
4.
Pt(s) | OH–(aq,1 moldm-3) | O2 (g,1 atm) || Cl2 (g,1 atm) | Cl–(aq,1 moldm-3) | Pt(s)
5.
Eo(cell) = Eo(c) + Eo(a)
= +1.36V – 0.40V
= +0.96V
- ඇනෝඩ ක්රියාවට නිෂ්ක්රීය ඉලෙක්ට්රෝඩයක් සම්බන්ධ වන විට එය මුලින්ද කැතෝඩ ක්රියාව සඳහා නිෂ්ක්රීය ඉලෙක්ට්රෝඩයක් සම්බන්ධ වන විට එය පසුවද ලිවිය හැක. නැතිනම් වායුව අසල නිෂ්ක්රීය ඉලෙක්ට්රෝඩය යෙදිය හැක.
රසායනික කෝෂයක විද්යුත් ගාමක බලය කෙරෙහි උෂ්ණත්වය හා සාන්ද්රණයේ බලපෑම
- රසායනික කෝෂයක් ක්රියාත්මක වන විට කෝෂය රත්වීම නිරීක්ෂණය කළ හැක. එයින් තහවුරු වනුයේ කෝෂ ප්රතික්රියාව තාප දායක වන බවයි.

ඇනෝඩ Zn(s) → Zn(aq)2+ + 2e
කැතෝඩ Cu(aq)2+ + 2e → Cu(s)
සමතුලිත Zn(s) + Cu(aq)2+ → Zn(aq)2+ + Cu(s)
- [ Zn2+ ] සාන්ද්රනය වැඩි වන විට සමතුලිතය ආපසු නැඹුරු වන නිසා කෝෂය විද්යුත්ගාමක බලය අඩු වේ.
- [ Zn2+ ] සාන්ද්රනය අඩු වන විට සමතුලිත ඉදිරියට නැඹුරු වන නිසා විද්යුත් ගාමක බලය වැඩි වෙයි.
- [ Cu2+ ] සාන්ද්රනය වැඩි වන විට සමතුලිත ඉදිරියට නැඹුරු වන නිසා විද්යුත් ගාමක බලය වැඩිවේ.
- [ Cu2+ ] සාන්ද්රනය අඩු වන විට සමතුලිත ආපසු නැඹුරු වන නිසා විද්යුත් ගාමක බලය අඩු වේ.
- උෂ්ණත්වය වැඩි වන විට සමතුලිතය ආපසු නැඹුරු වන නිසා විද්යුත් ගාමක බලය අඩුවේ .
- උෂ්ණත්වය අඩු කළ විට සමතුලිතය ඉදිරියට නැඹුරු වන නිසා වි.ගා.බ වැඩි වේ.
- කෝෂ ක්රියාව ස්වයං සිද්ධ වේ එම නිසා එහි ගිබ්ස් ශක්තිය (-) වේ.
සාන්ද්රණ කෝෂ
- ඉලෙක්ට්රෝනයක සාන්ද්රණය වෙනස් කිරීමෙන් සාදාගන්නා වෙනස් ඉලෙක්ට්රෝඩ එකිනෙක සම්බන්ධ කර සාන්ද්රණ කෝෂයක් පිළියෙළ කරගත හැක.
උදා: 1M ZnSO4 ද්රාවණයක් හා 0.5 M ZnSO4 ද්රාවණයක් භාවිතයෙන් සාදාගන්නා ඉලෙක්ට්රෝඩ
E°(Zn2+ | Zn) = -0.76 V
Zn(aq)2+ + 2e ⇌ Zn(s)

- ඉහත ඉලෙක්ට්රෝඩයේ සමතුලිතය සැලකූ විට[ Zn2+] සාන්ද්රණය අඩු වන විට සමතුලිතය ආපසු නැඹුරු වෙයි .එවිට එහි ඉලෙක්ට්රෝඩය මත ඉලෙක්ට්රෝන අතිරික්තයක් පවතින නිසා එම ඉලෙක්ට්රෝන සන්නායක කම්බිය දිගේ සාන්ද්රණය වැඩි ඉලෙක්ට්රෝඩය වෙත ගමන් කරයි .
- එවිට සාන්ද්රණය වැඩි ඉලෙක්ට්රෝඩයේ ඔක්සිහරණය සිදුවේ .
- මෙම අවස්ථාවේ සාන්ද්රණ කෝෂයක සාන්ද්රණය අඩු ඉලෙක්ට්රෝඩය ඇනෝඩය වන අතර සාන්ද්රණය වැඩි ඉලෙක්ට්රෝඩය කැතෝඩය වේ .
A මත ,
Zn(s) → Zn(aq)2+ + 2e
B මත,
Zn(aq)2+ + 2e → Zn(s)
4.සාන්ද්රණ කෝෂයක දී කෝෂ වල සාන්ද්රණ සමාන වූ විට ධාරාව ගලා යාම නවතී.
ද්රව සන්ධියක් නොමැති කෝෂ
- මෙහිදී භාවිතා කරන කරන ද්රාවණය ඉලෙක්ට්රෝඩ දෙකටම පොදුවේ .කෝෂය සම්මතව නිරූපණයේ දී ලවණ සේතුවක් දැක්විය නොහැක. එනම් සමාන්තරව ඉරි යෙදිය නොහැක .
- AgCl(s) ඉලෙක්ට්රෝඩය හා H2(g) ඉලෙක්ට්රෝඩය භාවිතයෙන් සාදා ගන්නා රසායනික කෝෂය සලකමු.

ඇනෝඩ H2(g) → 2H(aq)+ 2e
කැතෝඩ AgCl(s) + e → Ag(s) + Cl–
කෝෂ H2 + AgCl(s) → 2H(aq)+ + 2Ag(s) + 2Cl–
IUPAC අංකනය Pt(s) | H2(g) | H(aq)+ , Cl(aq)– | AgCl(s) |Ag(s)
උදා: පහත දැක්වෙන අන්දමට විද්යුත් රසායනික කෝෂයක් සකසා ඇත.

Ag (s) |AgCl (s) | Cl – හා Pt (s) | Hg(l) | Hg2Cl2(s) |Cl –(aq) යන ඉලෙක්ට්රෝඩ වල සම්මත ඉලෙක්ට්රෝඩ විභවය පිළිවෙලින් +0.22 V හා 0.27 V වේ.
1.ඉහත කෝෂ සඳහා කෝෂ සටහන ලියන්න.
Ag(s) |AgCl(s) |Cl–(aq,1moldm-3) |Hg2Cl2(s) |Hg(l) |Pt(s)
2.ඔක්සිකරණ ප්රතික්රියාව ලියන්න.
Ag(s) + Cl(aq)– → AgCl(s) + e
3.ඔක්සිහරණ ප්රතික්රියාව ලියන්න.
Hg2Cl2(s) + 2e → 2Hg(l) + 2Cl(aq)–
4.කෝෂ ප්රතික්රියාව ලියන්න.
Hg2Cl2(s) + 2Ag(s) → 2Hg(l) + 2AgCl(s)
5.කෝෂයේ විද්යුත්ගාමක බලය හොයන්න.
E0 = E0c – E0a
= 0.27V – 0.22V
= 0.05V
6.ඉහත කෝෂයේ විද්යුත් ගාමක බලය කෙරෙහි [Cl -] හි බලපෑම හේතු සහිතව පහදන්න.
Cl- අයන සමස්ත කෝෂ ප්රතික්රියාවට ඇතුලත් නොවේ. එම නිසා Cl- අයන සාන්ද්රණය කෝෂයේ විද්යුත් ගාමක බලය කෙරෙහි බල නොපායි.
ප්රායෝගිකව භාවිතා වන කෝෂ
-
ප්රාථමික කෝෂ
විද්යුත් ශක්තිය සැපයීමෙන් ආපසු හැරවිය නොහැකි කෝෂ ප්රතික්රියාවක් සහිත රසායනික කෝෂයක් ප්රාථමික කෝෂයකි.
(i)ඩැනියල් කෝෂය
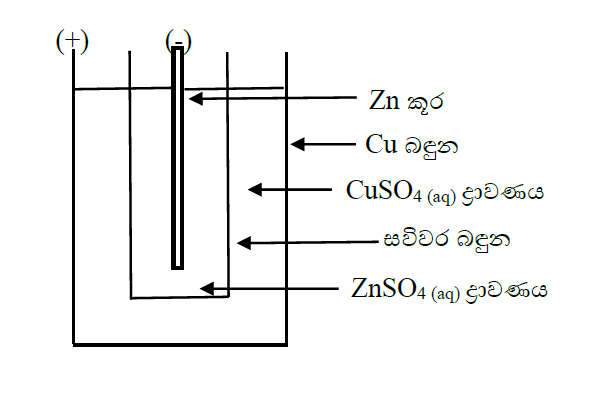
විදුත් විච්කේදය – ZnSO4 / CuSO4
(+) ධ්රැවය – Cu
(-) ධ්රැවය – Zn
ඇනෝඩ Zn(s) → Zn(aq)2+ + 2e
කැතෝඩ Cu(aq)2+ + 2e → Cu(s)
(ii)සාමාන්ය ලෙක්ලාන්ච් කෝෂය

විද්යුත් විච්චේද්ය – NH4Cl (ZnCl2 ද ගත හැක)
(+) ධ්රැවය – C / MnO2
(-) ධ්රැවය – Zn
ඇනෝඩ 2NH4(aq)+ + 2MnO2(s) + 2e → Mn2O3(s) + H2O(l) + 2NH3(aq)
කැතෝඩ Zn(s) → Zn(aq)2+ + 2e
2. ද්විතියීක කෝෂ
- විසර්ජනය වීමෙන් අනතුරුව ප්රථිඵල පුනර්ජනනය කළ හැකි කෝෂයක් ද්විතියීක කෝෂයකි.
- ආරෝපණය කිරීමේදී කෝෂ ප්රතික්රියාව ආපසු සිදුවේ.
උදා:- ඇකියුමිලේටරය (වාහන බැටරිය)
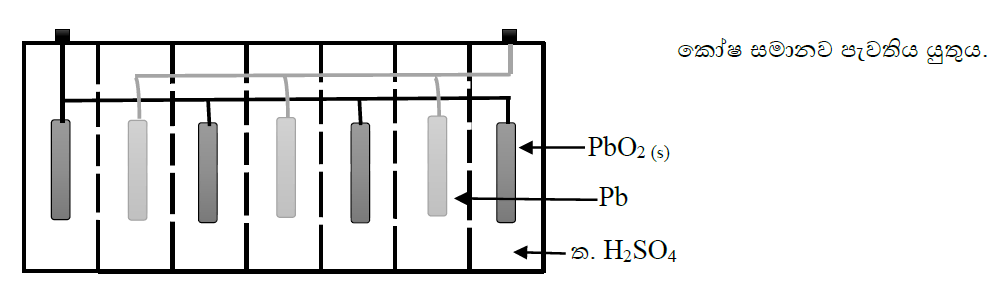
- විද්යුත් විච්චේද්ය – ත. H2SO4
- කැතෝඩය – Pb
- ඇනෝඩය – PbC2
ඇනෝඩ Pb(s) + SO4(aq)2- → PbSO4(s) + 2e
කැතෝඩ PbO2(s) + 4H(aq)+ + SO4(aq)2- + 2e → PbSO4(s) + 2H2O(l)
කෝෂ Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
3. ඉන්ධන කෝෂ
- ප්රතික්රීයක අඛණ්ඩව බාහිරින් සැපයෙන කෝෂයක් ඉන්ධන කෝෂයකි.
- මෙහිදී යොඩාගැනෙන විඩ්යුත් විච්ඡේද්ය වනුයේ 200 ක පමණ පවත්වා ගනු ලබන සා. ද්රාවණයකි.
- ඉලෙක්ට්රෝඩ ලෙස ඉලෙක්ට්රෝඩ බොහෝවිට භාවිතා වේ.

ඔක්සිකරණ 2H2(g) + 4OH(aq)– → 4H2O(l) + 4e
ඔක්සිහරණ O2(g) + 2H2O(l) + 4e → 4OH(aq)–
කෝෂ 2H2(g) + O2(g) → 2H2O(l)
විද්යුත් රසායනික කෝෂ පිළිබඳව වැඩිදුර අධ්යයනය සඳහා :-

