1. PH අගය
- ජලයේ පවතින හයිඩ්රජන් විභවය මැනීම මෙයින් සිදු කරයි.(potential of Hydrogen).මෙයින් ජලයේ ආම්ලික හෝ භාෂ්මිකතාවය ප්රකාශ කර හැක.
- මෙම අගය දක්වනු ලබන්නේ ද්රාවණයක හයිඩ්රජන් අයන සාන්ද්රණය සෘණ ලඝු අගයක් ලෙස ප්රකාශ කළ විටයි.
PH අගය නිරික්ෂණය කිරිමට ක්රම කීපයක් ඇත.
- අනුමාපනයක් හෝ වෙනත් ක්රමයක් මගින්- මෙම ක්රමය ඉතා නිරවද්ය වේ.
- PH දර්ශක භාවිතයෙන් – මෙහිදී අදාල pH පත්රයේ ද්රාවණය පොගවා ලැබෙන වර්ණය සම්මත pH වර්ණ පරිමාණය හා ගැලපීමෙන් දළ pH අගයක් ලබාගත හැකිය.
- PH මීටරයක් භාවිතයෙන් – මෙහිදී ජලයේ H+ අයන සාන්ද්රණය සමග විභවය වෙනස් වෙන විශේෂ ඉලෙක්ට්රොඩයක විභවය(වීදුරු) සම්මත ඉලෙක්ට්රෝඩයක විභවයට සාපේක්ෂව මැන ගනු ලැබේ(Ag/AgCl).මෙමගින් සෘජුවම PH අගය සෙවිය හැක.
- සාමාන්ය පානීය ජලය PH පරාසය 6.5 ත් 8.5ත් අතර විය යුතුය.
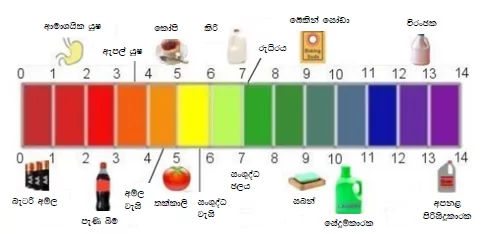
එදිනෙදා ජීවිතයේදී හමුවන ද්රාවණ කීපයක pH අගයන්
2.සන්නායකතාවය
- ජලයට විද්යුතය සන්නයනය කිරීමේ හැකියාවක් පවතී.මෙය මිනුමක් ලෙස මැන බැලීම මගින් ජලයේ සන්නායකතාවය ලබා ගනී.
- ජලය සන්නායකතාවයට ප්රධාන වශයෙන් හේතු වන්නේ ජලයේ දියවී ඇති ලවණ ප්රමාණයයි.ලවණ ජලයේ දියවූ විට කැටායන සහ ඇනායන බවට පත්වී සජලනය වූ අයන ලෙස පවතී.
- මෙම අයන වලට ජලයේ ඔබ මොබ ගමන් කිරීමට හැකි බැවින් විභව අන්තරයක් සැපයූ විට ඉලෙක්ට්රෝඩ වෙත ගමන් කිරීම මගින් සන්නායකතාව ඇති කරයි.
- සන්නායකතාවය සදහා ජලයේ ද්රාවණය වන අකාබනික ලවණ, ජලයේදී අයන බවට විඝටනය විය හැකි කාබනික ලවණ හා සංයෝග(කාබනික අම්ල භෂ්ම ආදිය) දායක වෙයි. ජලයේ හොදින් දියවෙන එහෙත් අයන බවට විඝටනය නොවන (ග්ලූකෝස්, සුක්රෝස්) වැනි කාබනික සංයෝග සන්නායකතාවයට දක්වන දායකත්වය අල්පය..
- සන්නායකතාව මැන බැලීම සඳහා සෙන්ටිමීටරයකට සීමන්ස් (Scm-1) යන ඒකකය භාවිතා කරයි.
- එහෙත් අපට හමුවන බොහෝ ජලීය ද්රාවණ වල මෙම අගය කුඩා අගයක් බැවින් සෙන්ටිමීටරයට මයික්රොසීමන්ස් (μScm-1) ලෙස සන්නායකතාව බොහෝ විට වාර්ථා කරයි. සන්නායකතාවය මැන බැලීම සඳහා සන්නායකතා මානය භාවිතා කරයි.
|
ද්රාවණය |
සන්නායකතාවය/µS cm-1 |
|
අයන ඉවත් කළ ජලය
|
0.1-5 |
|
ආස්රැත ජලය
|
1-10 |
|
පානීය ජලය
|
50-1000 |
|
කිරි
|
1000 |
|
0.01M KCLද්රාවණය සන්නායකතා සම්මත ද්රාවණය
|
1410 |
|
භූ ගත ජලය
|
100-8000 |
|
මුහුදු ජලය
|
2000-60000 |
|
ඇපල් යුෂ
|
1000 |
|
සාන්ද්ර අම්ල
|
60000- 900000 |
3.ආවිලතාව
- පිරිසිදු ජලය පූර්ණ ලෙස පාරදෘශ්ය වේ.එහෙත් ජලයට යම් යම් ද්රව්ය එකතු වීම නිසාවෙන් ජලයේ පාරදෘශ්යතාවය අඩුවී ජලය අපැහැදිලි ලෙස දිස්වේ.මෙසේ ජලයේ පාරශ්යතාවතාව අඩු වී දිස්වීම ජලයේ ආවිලතාවයයි.
- මෙසේ ආවිලතාව ඇති වනුයේ ජලයේ ද්රාවණය නොවූ ගුරුත්වය මගින් තැන්පත් නොවන අංශු පැවතීම හේතුවෙනි.
- මෙම අංශු පැවතීම හේතුවෙන් ජලය තුළින් ගමන් කරන ආලෝකය ප්රකිරණයට ලක් වෙයි.එම නිසාවෙන් ජල සාම්පලය සාම්පලය වලාකුළක් හෝ තිමිර පටලයක් ලෙස දිස්වේ.
- ආවිලතාව ජල දූෂණයේ දෘශ්යමාන අවස්ථාවකි.
- ජලයේ ආවිලතාවය ට හේතු වන්නේ මැටි අංශු කුඩා කාබනික හා අකාබනික අංශු,ඒක සෛලික ජීවීන් ගේ කොලනි සහ ඉතා සියුම් බහු අවයවක අංශු ආදියයි.
- ජලයේ ආවිලතාවය ආලෝක කදම්භයක් ජලය තුළ කොපමණ ප්රකිරණය වෙනවාද යන්න මැනීම මගින් මැන බැලේ.
- මෙය සිදු කරන්නේ සාම්පලය තුළ ඇතිවන ප්රකිරණය දන්නා ආවිලතාවයක් ඇති ද්රාවණයක ප්රකිරණය හා සංසන්දනය කිරීම මගිනි.
- ආවිලතාව මනින ඒකකය nephelometric turbidity unit(NTU) වෙයි.

4.ජලයේ කඨිනත්වය
- ජලයේ කඨිනත්වය අර්ථ දක්වන්නේ ජලයේ සබන් අවක්ෂේප කිරීමේ ධාරිතාව ලෙසයි.
- කඨිනත්වය සඳහා බහු සංයුජ ලෝහ කැටායන හෝ වෙනත් ඕනෑම බහු සංයුජ ලෝහ කැටායන වල සමස්ත සාන්ද්රණය බලපායි.(Ca2+,Mg2+,Fe2+,Mn2+,Al3+).
- ජලය වැඩිපුර ම පවතින බහු සංයුජ ලෝහ කැටායන වනුයේ Ca2+ සහ Mg2+ ය.මෙම කැටායන ස්වභාවික කඨිනත්වය සඳහා සම්පූර්ණයෙන්ම පාහේ දායක වේ.
- ඊට අමතරව Mn2+,Fe2+,Al3+ වැනි අයන ද කටිනත්වය සඳහා ඉතා කලාතුරකින් බලපායි.
- සබන් යනු මේද අම්ල වල සෝඩියම් හෝ පොටෑසියම් ලවණ වේ.මෙම ලවණයේ කාබොක්සලික් කාණ්ඩය බහු-සංයුජ ලෝහ කැටායනය සමග එක්ව සාදන සංයෝගය ජලය ද්රාව්යතාවය අඩු නිසා අවක්ෂේපණය ට ලක් වෙයි.
- මෙම අවක්ෂේපයේ ඝනත්වය ජලයේ ඝනත්වයට වඩා අඩු බැවින් සබන් මණ්ඩි ලෙස මේවා ජලයේ පාවේ.
- එමනිසා නිදහස් ජලයේ බහු-සංයුජ කැටායන පවතින විට ඒවා සබන් සමග ප්රතික්රියා කරන බැවින් සබන් වල ශෝධන ක්රියාව සිදු කිරීමට අපහසුතාවයක් දක්වයි.
- මෙහිදී ජලයේ පවතින වෙනත් ඇනායන ස්ථිර කඨිනත්වයට කිසිදු කිසිදු සම්බන්ධතාවයක් නොමැත.(Cl–, SO42-).
- ජලයේ කඨිනත්වය ප්රකාශ කරන ඒකකය වනුයේ කැල්සියම් කාබනේට් මිලියනකට කොටස් ලෙසයි.(ppm CaCO3)
|
කැල්සියම් කාබනේට්/mg L-1 |
ජලයේ තත්ත්වය |
|
0-50 |
මෘදු ජලය |
|
50-100 |
මධ්යස්ථ මෘදු ජලය |
|
100-200 |
මදක් කඨින ජලය |
|
200-300 |
මධ්යස්ථ කඨින ජලය |
|
300-450 |
කඨින ජලය |
|
450+ |
අධික කඨින ජලය |
තාවකාලික කඨිනත්වය
- ජලයේ බහු සංයුජ ලෝහ කටායන සමඟ එම මුළු සාන්ද්රනයට වඩා වැඩිපුර සාන්ද්රනය කින් බයිකාබනේට් අයන සහ කාබනේට් අයන පැවතීම තාවකාලික කඨිනත්වයි.
- මෙය තාවකාලික කඨිනත්වය ලෙස සදහන් කරනුයේ එය ජලය නැටවීම මගින් ඉවත් කිරීමට හැකි බැවිනි. මෙහිදී ජලය නැටවීමේදී අදාල ලෝහ කැටයන ඒවායේ කාබනේට් ලෙස අවක්ෂේප වේ.
\begin{array}{l}\mathrm{Ca}^{2+}\;+{\mathrm{HCO}}_3^{2-}\xrightarrow\bigtriangleup{\mathrm{CaCO}}_3+{\mathrm{CO}}_2+{\mathrm H}_2\mathrm O\\\mathrm{Mg}^{2+}\;+{\mathrm{HCO}}_3^{2-}\xrightarrow\bigtriangleup{\mathrm{MgCO}}_3+{\mathrm{CO}}_2+{\mathrm H}_2\mathrm O\end{array}
ස්ථිර කඨිනත්වය
- බහු සංයුජ ලෝහ කැටායන සමග බයිකාබනේට් හා කාබනේට් අයන එම කැටයාන සාන්ද්රණයට වඩා අඩුවෙන් පැවතීම ස්ථිර කඨිනත්වය ලෙස හැඳින්වෙයි.
- මෙහිදී කාබනේට් සහ බයිකාබනේට අයන වල සාන්ද්රණය අඩු නිසා ලෝහ අයන රත් කිරීම මගින් අවක්ෂේප කළ නොහැක.එම නිසා මෙම කඨිනත්වය ස්ථීර කඨිනත්වය ලෙස හඳුන්වයි.එම නිසා බැහැරින් ජල ද්රාවිත කාබනේට සංයෝග ජලයට එක් කිරීම මගින් ස්ථිර කඨිනත්වය ඉවත් කර හැක.(Na2CO3)
\begin{array}{l}\mathrm{Ca}^{2+}\;+2\;\mathrm{Cl}^-+{\mathrm{Na}}_2{\mathrm{CO}}_3\rightarrow{\mathrm{CaCO}}_3+2\;\mathrm{Na}^++2\;\mathrm{Cl}^-\\\end{array}
5.ජලයේ රසායනික ඔක්සිජන් ඉල්ලුම (COD)
- ජලයේ රසායනික ඔක්සිජන් ඉල්ලුම යනු ජලයේ ද්රාවිත ඔක්සිකරණය කළ හැකි ද්රව්ය ඔක්සිකරණය කිරීම සඳහා අවශ්ය වන ඔක්සිජන් ප්රමාණයයි.
- ජලයේ බහුලවම පවතින ඔක්සිකරණය කල හැකි සංයෝග වනුයේ විවිධ කාබනික සංයෝගයි. මේවා විවිධ ඔක්සිකරණ අවස්ථා වල පවතින අතර අවසානයේ CO2 (හෝ කාබනේට) බවට ඔක්සිකරණය කල හැකිය.
- මේද අම්ල, ඇමයිනෝ අම්ල, ග්ලූකෝස් හා ෆෘක්ටෝස් වැනි සීනි වර්ග, පිෂ්ටය, ප්රෝටීන මෙම ගණයට අයත් වේ.
- ඊට අමතරව Mn2+,Fe2+ වැනි අකාබනික අයන ද ජලයේ රසායනික ඉල්ලුමට දායක වෙයි.
- ජලයේ රසායනික ඔක්සිජන් ඉල්ලුම නිර්ණය කිරීම අනුමාපනයක් මගින් සිදු කරයි.
- ජල සාම්පලය ආම්ලික පොටෑසියම් ඩයික්රෝමේට් දන්නා ප්රමාණයක් සමග ආසවනය කර ඉතිරි වන ඩයික්රෝමේට් අයන ප්රමාණය සම්මත Fe2+ අයන ද්රාවණයක් මගින් අනුමාපනය කර ජලයේ COD අගය ගණනය කරයි.
- මෙසේ බොහෝවිට (COD) මනිනු ලබන්නේ කර්මාන්ත මගින් පිට කරන ලද අප ජලයෙහි ය.ඒ එම ජලය අධිකව ජලාශවලට එක් වෙන බැවින් ජලාශ දූෂණයට ලක්වන නිසාය.
|
ඉවත ලන ද්රව්ය |
උපරිම COD අගය/ mg L-1 |
|
මතුපිට ජලයට බැහැර කරන කාර්මික අපජලය |
250 |
|
වාරිමාර්ග ජලයට බැහැර කරන කාර්මික අපජලය |
400 |
|
සාගර ජලයට බැහැර කරන කාර්මික අපජලය |
250 |
|
රබර් කර්මාන්තශාලාවලින් ඉවත ලන අපජලය |
400 |
|
රෙදි කර්මාන්තශාලාවලින් ඉවත ලන අපජලය |
250 |
6.ජලයේ ද්රාවිත ඔක්සිජන් මට්ටම(DOL)
- ජලයෙ ඒකක පරිමාවක දිය වි ඇති අණුක ඔක්සිජන් ප්රමාණය (O2) ජලයේ ද්රාවිත ඔක්සිජන් මට්ටම ලෙස හඳුන්වයි.
- ජලජ හා ශාක ජීවීන් (ඇල්ගී , සයනොබැක්ටීරියා) විසින් සූර්යාලෝකය හමුවේදී වායුගෝලයේ පවතින ඔක්සිජන් 21% ජලයේ දියවීම හා ජලජ පැලෑටි වල ප්රභාසංස්ලේෂණය නිසා ඇතිවෙන ඔක්සිජන් ජලයේ ඔක්සිජන් ප්රමාණය නිර්ණය කරයි.
- ජලය ධ්රැවීය නිසාත් ඔක්සිජන් නිර්ධ්රැවීය නිසාත් ජලයේ දියවෙන ඔක්සිජන් ප්රමාණය ඉතා කුඩාය.
- ජලයේ සිදුවන විවිධ රසායනික හා ජෛව ක්රියාවලි හේතුවෙන් ජලයේ පවතින ඔක්සිජන් මට්ටම අඩු වේ.
- මෙම මට්ටම 5ppm වඩා අඩු වුවහොත් ජලජ ජීවීන් ආතතියට පත්වේ.ජීවීන් ජලය මතුපිටට පැමිණ මුව වායුගෝලයට විවෘතව තැබීම වැනි ලක්ෂණ මෙහිදී දැකගත හැකිය.
- ජලයේ ද්රාවිත ඔක්සිජන් මට්ටම 1-2ppm පමණ ප්රමාණයට අඩු වූ විට ජලයේ ජීවත් වන ජීවීන් මිය යෑමට පටන් ගනී.
- එම මට්ටම 0ppm අගයට ලංවන විට ජලයේ නිර්වායු තත්ත්ව ඇති වෙයි.
ජලයේ ද්රාවිත ඔක්සිජන් මට්ටම මැනීම සඳහා ක්රම කිහිපයක් ඇත.
- ද්රාවිත ඔක්සිජන් වලට සංවේදී ඔක්සිජන් මීටරයක් මගින් මැන ගැනීම
- අනුමාපනයක් මගින් මැන ගැනීම(වින්ක්ලර් ක්රමය)
- වින්ක්ලර් ක්රමය මගින් ජලයේ ද්රාවිත ඔක්සිජන් මට්ටම මැනීම පහත පරිදි සිදු කළ හැක.
මෙහිදී ප්රථමයෙන් ද්රාවිත O2 මැංගනීස් හයිඩ්රොක්සයිඩ (Mn(OH)2) සමග ප්රතික්රියා කරවා අවක්ෂේප වීමට ලක් කරයි.
2\;\mathrm{Mn}{\left(\mathrm{OH}\right)}_2+\overset{\mathrm{ජලයේ}}{\underset{1\;\mathrm{mol}}{{\mathrm O}_2}}\rightarrow\underset{2\;\mathrm{mol}}{2\;{\mathrm{MnO}}_2}+2\;{\mathrm H}_2\mathrm O\;\cdots\cdots\cdots(1)
මෙසේ සාදන මැංගනීස් සංකීර්ණය ආම්ලික මාධ්යකදී අයඩයිඩ අයන සමග ප්රතික්රියා කරවයි.
\underset{1\;\mathrm{mol}}{{\mathrm{MnO}}_2}+4\;\mathrm H^++2\mathrm I^-\rightarrow\mathrm{Mn}^{2+}+\underset{1\;\mathrm{mol}}{{\mathrm I}_2}+2\;{\mathrm H}_2\mathrm O\;\cdots\cdots\cdots(2)
මෙහිදී පිටවන I2 ප්රාමාණික තයෝසල්ෆේට් ද්රාවණයක් සමග අනුමාපනය කරනු ලැබේ.
\underset{1\;\mathrm{mol}}{{\mathrm I}_2}+\underset{2\;\mathrm{mol}}{2\;{\mathrm S}_2{\mathrm O}_3^{2-}}\rightarrow2\;\mathrm I^-+{\mathrm S}_4{\mathrm O}_6^{2-}\;\;\cdots\cdots\cdots(3)
මෙහිදී එක් ඔක්සිජන් මවුලයක් සදහා තයෝසල්ෆේට් මවුල 4ක් වැය වෙයි. විද්යාගාරයේදී විවිධ ජල සාම්පලවල ද්රාවිත ඔක්සිජන් මට්ටම මේ ක්රමය මගින් නිර්ණය කළ හැකිය.
(1),(2),(3) අනුව ,
\underset{1\;\mathrm{mol}\;\;:}{{\mathrm O}_2}\equiv\;\underset{2\;\mathrm{mol}\;:}{{\mathrm{MnO}}_2}\equiv\;\underset{2\;\mathrm{mol}\;:}{{\mathrm I}_2}\equiv\;\underset{4\;\mathrm{mol}}{{\mathrm S}_2{\mathrm O}_3^{2-}}
7.ජලයේ සුපෝෂණය (eutrophication)
- පෝෂක ද්රව්ය ජලයට එක්වීම හේතුවෙන් ජල පෘෂ්ඨයේ අධික ලෙස ඇල්ගී වර්ධනය වීම ජලය සුපෝෂණය ලෙස අර්ථ දක්වයි.
- මෙම නිසා අධික ලෙස ඇල්ගී වර්ධනය වන අතර ඇල්ගී ඝන කොලනි ස්ථරයක් ලෙස පවතී.එම නිසාවෙන් ජලයේ පහළ ස්තරවලට හිරු එළිය ළඟා නොවෙයි.
- එමනිසා පහළ ස්ථරවල ප්රභාසංස්ලේෂණය සිදු නොවීමෙන් හා ඔක්සිජන් ද්රාවණය නොවීමෙන් ජලජ සතුන් සහ ශාක මිය යයි.මෙසේ මිය යන ශාක සහ සතුන් ස්වායු බැක්ටීරියා මගින් වියෝජනයට ලක් කරයි.
- මෙමගින් ජලයේ ඔක්සිජන් මට්ටම තවදුරටත් පහළ යන අතර අවසානයේදී නිර්වායු තත්ත්වයක් ඇති කරයි.
- මෙම තත්ත්වය නිසා H2S වැනි වායු නිපදවීම නිසා ජලාශය අධික දුර්ගන්ධයක් ඇති ප්රදේශයක් බවට පත් කරයි.
- පොස්පේට් අයන ඇල්ගී වර්ධනයට සීමාකාරී පෝෂකයයි.එසේම නයිට්රේට් අයන සමහර අවස්ථාවලදී සීමාකාරී සාධකය වෙයි.මෙම දෙවර්ගය සීමාකාරී වීම හේතුවෙන් ජලයේ ඇල්ගී නිපදවීම සීමා වී ඇත.
- මිනිස් ක්රියාකාරකම් හේතුවෙන් කාර්මික අපජලය මගින් හා නිවසේ භාවිත කරන ලද පිරිසිදුකාරක ලෙසින් ජලාශ වලට පොස්පේට් සහ නයිට්රේට් එකතු වෙයි.මෙම නිසාවෙන් ජලාශ තුල අධික ලෙස ඇල්ගී වර්ධනය ඇති වෙයි.(PO43- , NO3–)
8.ජලයේ බැරලෝහ අයන පැවතීම
බැර ලෝහ අයන තීරණය කිරීමට ඉතා නිවැරදි නිර්වචන භාවිතා වේ.
- ලෝහ විද්යාවේදී බැර ලෝහයක් ලෙස තීරණය කරන්නේ සාපේක්ෂ ඝනත්වය 5 gcm-3 ට ඉහළ ලෝහයි.
- භෞතික විද්යාවේ දී මෙය පරමාණුක ක්රමාංකය 20 ට ලෙස ඉහල ඉහළ ලෝහ නිර්වචන කරයි.
- රසායන විද්යාවේ දී සල්ෆයිඩ් සහ හයිඩ්රොක්සයිඩ අයන (S2- , OH-1) සමඟ අද්රාව්ය අවක්ෂේපය සාදන කැටායන නිපදවන ලෝහ ලෙස බැර ලෝහ නිර්වචනය කරයි.
- සමහර අවස්ථාවලදී මෙම බැර ලෝහ අත්යවශ්ය ක්ෂුද්ර පෝෂක(Fe2+,Zn2+) වුවද, වෙනත් අවස්ථාවලදී මේවා අහිතකර හා විෂදායි වෙයි.(Hg2+,Cd2+,Pb2+),ඊට අමතරව සමහර සංයෝග අඩු සාන්ද්රණයකින් යුක්ත වීම හිතකර ලෙසත් වැඩි සාන්ද්රණයකින් යුක්ත වීම අහිතකර ලෙසත් බලපායි.(Cu2+).
- මීට අමතරව සමහර බැරලෝහ කිසිදු ජෛව ක්රියාවලියකට දායක නොවේ.ඒවා පසේ, ජලයේ සහ ජලාශ වල පතුලේ අවසාදිත වෙයි.
- බැර ලෝහ ස්වභාවික ජලයේ සජලනය වූ අයන ලෙස සහ සංකීර්ණ සංයෝග ලෙස පවතී.
|
බැර ලෝහ |
ජලයට එකතු වන ප්රභවය |
බලපෑම් |
|
As (As2O3 ලෙස) |
කාර්මික අපජලය , පොස්පේට් පොහොර වල අපද්රව්ය ලෙස, භූගත ජලය, දිලීර නාශක, ඉලෙක්ට්රොනික උපාංග |
පිළිකාකාරක, ආසිනිකෝසියාව |
|
Cd (Cd2+) |
කාර්මික විසර්ජනය, ආකර අපද්රව්ය, ලෝහ පිරිපහදුව, නැවත ආරෝපණය කළ හැකි බැටරි |
එන්සයිම අක්රීය වීම, අධික රුධිර පීඩනය, වකුගඩු ආබාධ |
|
Pb (Pb+) |
කාර්මික විසර්ජනය, ආකර අපද්රව්ය, ලෙඩ් එකතු කළ ගැසොලින්, ලෙඩ් එකතු කළ තීන්ත. ලෝහ පෑස්සුම් ද්රව්ය |
වකුගඩු හා ප්රජනන අකර්මන්යතාවය, ළමයින්ගේ මනස සෙමෙන් වැඩි වීම, නීරක්තිය, හිමොග්ලොබින් නිෂේදකය |
|
Hg (Hg,Hg2+) |
කාර්මික විසර්ජනය, විවිධ ඛනිජ තුළ අංශු මාත්ර ලෙස පැවතීම, ගල් අගුරු දහනය, රසදිය අඩංගු උපකරණ, (CFL බල්බ, උෂ්ණත්වමාන, රික්ත උපකරණ) |
මොළයට හානි වීම. නින්ද් නොයෑම, වකුගඩු ආබාධ, මිනිමාටා රෝගය |
9.ද්රාවිත කාබනික සංයෝග
- ද්රාවිත කාබනික සංයෝග විෂදායිනොවන නමුත් ජෛව රසායනික ඔක්සිජන් ඉල්ලුමට(BOD)හා රසායනික ඔක්සිජන් ඉල්ලුම(COD) ට දායක වෙයි.
- කාබෝහයිඩ්රේට්, ලිපිඩ, මේද, ඇමයිනෝ අම්ල,ප්රෝටීන,ද්රාවිත හයිඩ්රොකාබන, ශාකවල ප්රාථමික හා ද්විතීයික පරිවෘත්ත සංයෝග සහ පරිවෘත්තීය අපද්රව්ය මෙම ගණයට අයත් වේ.
- මෙම සංයෝග ජලයේ ඇති විට බැක්ටීරියා මගින් වියෝජනය කරන නිසා ජලයේ ඔක්සිජන් ඉල්ලුම ඉහළ ගොස් භාවිත ඔක්සිජන් මට්ටම පහළ යයි. මේ නිසා ජලයේ ජෛව ක්රියාවලි කෙරෙහි බාධා ඇති වෙයි.
10.විෂ හෝ අන්තරාකාරී කාබනික සංයෝග
මේ කාබනික සංයෝග ඉතා කුඩා ප්රමාණයක් ජලයේ පැවතීම හේතුවෙන් ජලය භාවිතයට නුසුදුසු වේ
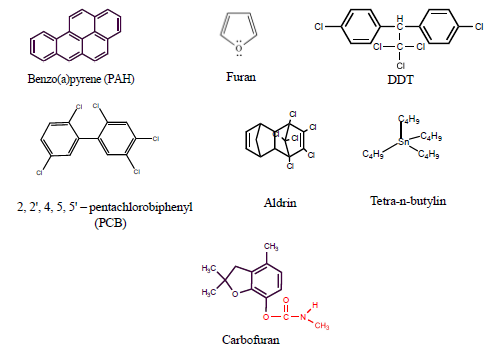
- මෙම සංයෝග බොහෝ කාලයක් නොනැවසී පවතී.පලිබෝධ නාශක,කාර්මික රසායනික ද්රව්ය, හැලජනීකෘත කාබනික සංයෝග,ඩයොක්සීන,පියුරෑන්, PCB (පොලික්ලෝරිනේටඩ් බයිෆින්යිල්) ,PAH (පොලිඇරෝමැටික් හයිඩ්රොකාබන්),ජල ජීවාණුහරණ අතුරුඵල මෙම ගණයට අයත් වේයි.
- ජලයේ අංශුමාත්ර ලෙස පවතින අධික විෂ සහිත කාබනික සංයෝග කීපයක් පහත දැක්වේ.
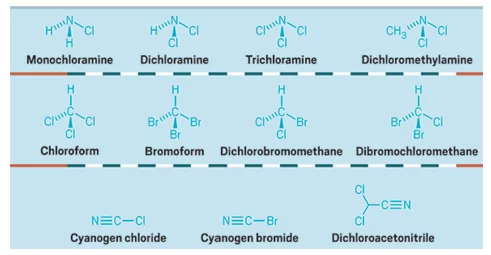
ජල ජීවාණුහරණ අතුරු ඵල යනුවෙන් හැදින්වෙනුයේ ජලය ජීවාණුහරණය සදහා යොදන ක්ලෝරීන් (Cl2) හෝ හයිපොක්ලෝරේට් ලවණ (NaOCl , Ca(OCl)2) මගින් ජලයේ ඇතිවන OCl– ජලයේදී ද්රාවණය වූ සමහර කාබනික සංයෝග සමග ප්රතික්රියා කර සාදන ක්ලෝරීන් අඩංගු සංයෝගයි. මේ සංයෝග විෂ සහිත වේ. පහත දැක්වෙනුයේ ජල ජීවාණුහරණ අතුරු ඵල සංයෝග කිහිපයකි.
11.ප්ලාස්ටික් ආකලන ද්රව්ය
- ප්ලාස්ටික් නිෂ්පාදනයේ දී බොහෝ ආකලන ද්රව්ය එකතු කරයි.මෙම ආකලන ද්රව්ය සෙමින් ප්ලාස්ටික් භාණ්ඩයෙන් කාන්දුවීම, වැරදි භාවිතයේදී හා භාවිතයෙන් පසු ජලයට හා පසට එක් වීම ජල දූෂණයට හා පස දූෂණයට හේතුවේ.
- මේවා පිළිකා කාරක ලෙස, හෝමෝන පද්ධතියට බලපෑම් සිදු කරන්නන් ලෙස, ශරීරයේ විවිධ ග්රන්ථි වලට , වකුගඩුවලට හානි කරන්නන් ලෙස ක්රියා කරයි.
|
ආකලන ද්රව්ය |
ගුණාංගය |
බලපෑම |
|
තැලේට්(phthalates) ඩයිඔක්ටයිල් තැලේට්(Dioctyl phthalate) ඩයිමීතයිල තැලේට්(Dimethyl phthalates) ඩයි(2- එතිල් හෙක්සයිල්) තැලේට් (Di(2 -ethyl hexyl) phthalates) |
සුවිකාර්ය ප්ලාස්ටික්,( නැමෙන සුළු ප්ලාස්ටික්) වර්ග නිපදවීමට |
අන්තරාසර්ග පද්ධතියේ හෝර්,ඕන ස්රාවය අඩු කරයි. පිළිකාකාරකය. |
|
ලෙඩ් වර්ණක PbCrO4 (කහ) Pb3O4 (කහ) PbCO3 (සුදු) |
දීප්තිමත් වර්ණ සහිත ප්ලාස්ටික් ලබා ගැනීම සදහා භාවිතා කරයි. |
මධ්ය ස්නායු පද්ධතිය හානිවීම, දරුවන්ගේ මානසික වර්ධනය අඩු වීම , වකුගඩු හානී වීම, පිළිකාකාරකය, වර්ධනය ප්රමාද වීම හා අන්තරාසර්ග පද්ධතියේ හෝර්මෝන ස්රාවය අඩු කරයි. |
|
බ්රෝමීන් අඩංගු ගිනි නිවාරක සංයෝග ඩෙකාබ්රෝමෝඩයිෆීනයිල් ඊතර් (Decabromodiphenyl ether) ටෙට්රාබ්රෝමෝබිස්ෆීනෝල් A (Tetrabromobisphenol A) |
ප්ලාස්ටික් කවර, විද්යුත් වයර, බුමුතුරුණු සහ ප්ලාස්ටික් පටලවල ගිනිනිවාරක ගුණය ලබා ගැනීමට |
ලිපිඩකමී හා ජෛව පටල තුළ එක්රැස් වී ස්නායු පද්ධතියට බලපෑම් කිරීම.අන්තරාසර්ග පද්ධතියේ හොර්මෝන ස්රාවය අඩු කිරීම. |
|
බිස්ෆිනොල් A (Bisphenol A) |
පොලිකාබනේට ප්ලාස්ටික් භාණ්ඩ (පාසල් ළමුන්ගේ ජල බෝතල හා ළදරුවන්ගේ බෝතල්වල) නිපදවීමේදී ඒකායවක ලෙස භාවිතා කරයි. PVC නිපදවීමේදී ප්රතිඔක්සිකාරකයක් ලෙස භාවිතා කරයි. බිස්ෆිනොල් A හි බහුඅවයවක ලෝහමය ටින් භාජනවල ඇතුළු පැත්තේ විඛාදනය වළක්වන ආරක්ෂාකාරී ආවරණයක ලෙස |
අන්තරාසර්ග පද්ධතියේ හෝර්මොන මට්ටම අඩු කරයි. ඊස්ට්රජන් හෝර්මෝනයට අනුකරණයක් ලෙස ක්රියාකාර ඊස්ට්රජන් වල ක්රීයාකරීත්වයට බාධා කරයි. කුඩා ළමුන්ගේ අවයව වර්ධනයට බාධා කරයි. |
|
ප්ලාස්ටික් නිෂ්පාදනවල අපද්රව්ය ලෙස ඉතිරි වී ඇති ඒකායවික හා උත්ප්රේරක සංයෝග. ඒකායවික ලෙස ස්ටයරීන් වයනයිල් ක්ලොරයිඩ් බිස්ෆිනොල් A , උත්ප්රේරක අංශු මාත්ර ලෙස Cr, Pb, Cd සහිත සංයෝග |
බහුඅවයවක නිපදවීමට භවිතා කරයි. බහුඅවයවක රෙසින නිපදවීම උත්ප්රේරණය කරයි.
|
ඉතා විෂදායි පිළිකාකරක සහ ජාන විකෘතිය ඇති කරයි. (ඒකායවික) උත්ප්රේක අපද්රව්ය පිළිකාකරක සහ ස්නායු විනාශ ඇති කරයි. |
වැඩිදුර අධ්යනයට ,

