බෙන්සින්වල භෞතික ගුණ
- ජලයේ ඉතා සුළු වශයෙන් ද්රාව්ය වේ.
- කාබනික ද්රාවකවල දිය වේ.
- තාපාංකය 80 °C
- ද්රවාංකය 5.5°C
- ඝනත්වය 0.88 gcm-3
- අවර්ණ ද්රව.
- ඉතා පහසුවෙන් ගිනි ගනියි.
- අධික කාබන් ප්රතිශතය නිසා අතිශය දැලි සහිත කහ දැල්ලකින් දහනය වේ.
- ඉහළ සම්ප්රයුක්ත එන්තැල්පිය නිසා අඩු උත්පාදන එන්තැල්පියක් ඇත.
බෙන්සින්වල බන්ධන ස්වභාවය
බෙන්සින්වල අණුක සුත්රය C6H6 වේ.නමුත් එය සාමාන්ය තත්ත්ව යටතේ අසංතෘප්ත සංයෝග සදහා කරන පරික්ෂණ වලට පිළිතුරු නොදේ. ඒ නිසා සරල ඇල්කීනයකට හෝ ඇල්කයිනයකට සමාන ව්යුහයක් බෙන්සින් වලට නැත.
බෙන්සින් වල ව්යුහය
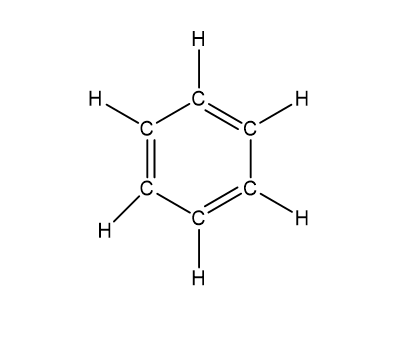
- කෙකුලේ විසින් යෝජනා කල බෙන්සින් වල ව්යුහය. එහි මාරුවෙන් මාරුවට ද්විත්ව බන්ධන 3ක් හා c පරමානු 6කින් සමන්විත වේ.
- නමුත් කෙකුලේ ව්යුහයද පැවතිය නොහැකි බව පහත හේතු නිසා සනාථ විය.
- C-C ඒක බන්ධනයකත් C=C බන්ධනයකත් බන්ධන දිග අසමාන වේ.නමුත් බෙන්සින් වල සියලුම C අතර බන්ධන දිග එක සමාන වේ.
- බෙන්සින් වලට කෙකුලේ ව්යුහය පවතියි නම්, ද්වි ආදේශිත ව්යුත්පන්න වලදි එකිනෙකට වෙනස් ඕතෝ සමාවයවික 2ක් පහත ලෙස පැවතිය යුතුය. කෙකුලේ යෝජනා කරන ආකාරයට තනි බන්ධන හා ද්ව්ත්ව බන්ධන මාරුවෙන් මාරුවට ඒ්වා තිබෙන ස්ථාන වෙනස් කර ගනී.
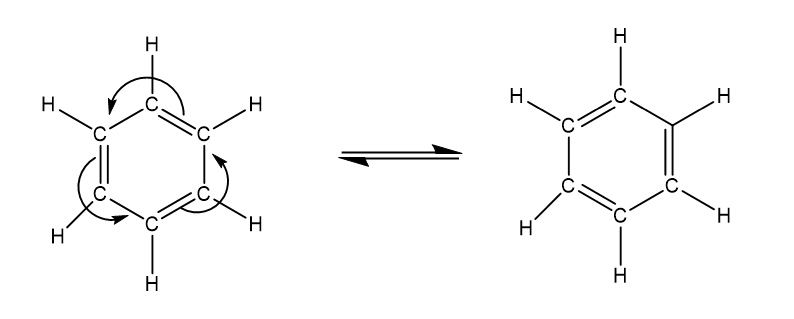
නමුත් මෙලෙස ව්යුහ 2ක් පවතින බවට කිසිදු පරීක්ෂණාත්මක සාක්ෂිවත් හමු වි නැත. එයද කෙකුලේ ව්යුහය පැවතිය නොහැකි බවට සාක්ෂියක් වේ.
- එම නිසා බෙන්සින් පහත ව්යුහ 2 සම්ප්රයුක්ත මුහුමක් ලෙස සලකනු ලබයි.
- මෙය පහත ආකාරයට දක්වනු ලබයි.
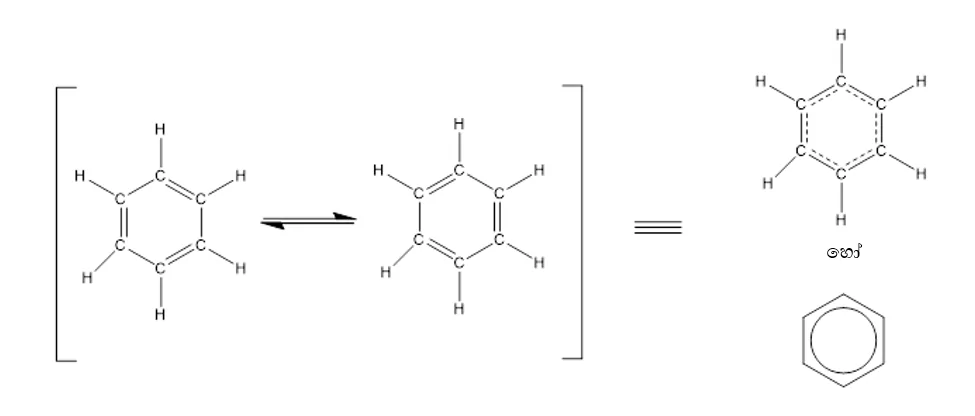
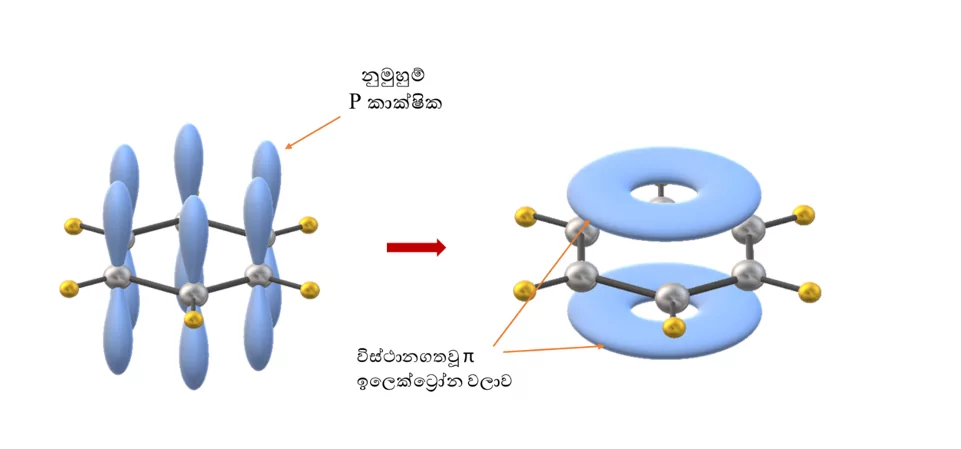
- බෙන්සින් වල සෑම කාබන් පරමාණුවකටම නුමුහුම් p කාක්ෂිකයක් ඇති අතර ඒවාට දෙපස ඇති නුමුහුම් p කාක්ෂිකය සමග අතිච්ඡාදනය විය හැක. එම නිසා පරමාණු 6ටම පොදු චක්රිය විස්ථානගත වු ඉලෙක්ට්රෝන වළාවක් ඇති වේ. එමනිසා සත්ය ව්යුහය ඉහත ව්යුහ 2හි මුහුමක් ලෙස සලකයි. සත්ය ව්යුහය උපකල්පිත කෙකුලේ ව්යුහයට වඩා ස්ථායි වේ.
බෙන්සින් වල ස්ථායිතාව
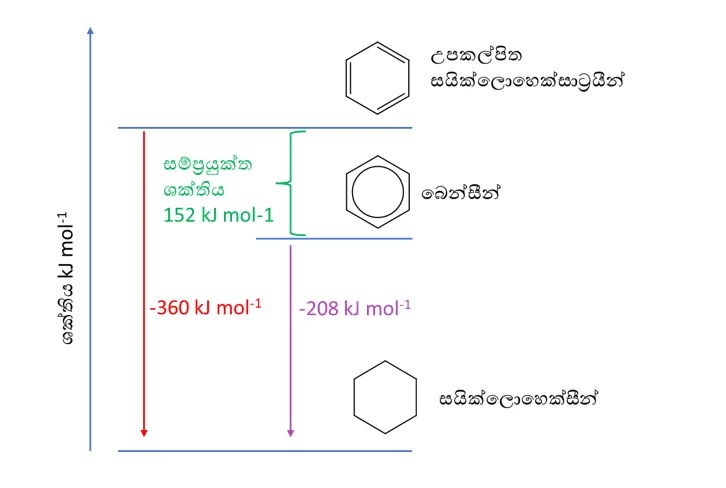
- මෙය සම්මත හයිඩ්රජනිකරණ එන්තැල්පි දත්ත ඇසුරෙන් පැහැදිලි කල හැක.
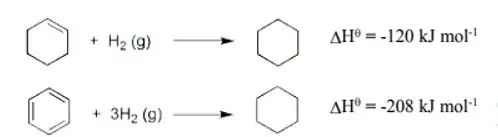
- ත්රිත්ව බන්ධන 3ක් හයිඩ්රජනිකරණය සදහා ලැබිය යුතු අගය -360 KJmol-1 වේ.
(-120 KJmol-1 × 3= -360 KJmol–1 )
- නමුත් සත්ය බෙන්සින් හයිඩ්රජනිකරණය සදහා ලැබුන අගය -208 KJmol-1 වේ.
- එමනිසා සත්ය බෙන්සින් කෙකුලේ ව්යුහයට වඩා (360-208)=152 KJmol-1 කින් ස්ථායි වේ.
- මෙම ස්ථායි බවට හේතුව π ඉලෙක්ට්රෝන මගින් ඇතිවන චක්රිය විස්ථානගත විම
බෙන්සින් සහ උපකල්පිත සයික්ලෝහෙක්සාට්රායින් වල සම්මත හයිඩ්රජනිකරන එන්තැල්පිය
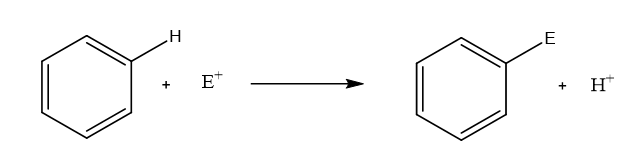
බෙන්සින් වල ලාක්ෂණික ප්රතික්රියා : ඉලෙක්ට්රොෆිලිකආදේශ ප්රතික්රියා(SE ප්රතික්රියා)
බෙන්සින් න්යෂ්ටියට හානියක් නොකට එහි C පරමාණු මත පිහිටි H පරමාණු ප්රතිස්ථාපනය කරමින් ඉලෙක්ට්රොෆිලික ආදේශ ප්රතික්රියා කිරිමේ හැකියාව බෙන්සින් හා අනෙකුත් ඇරෝමැටික වල ආවේණික ලක්ෂණයකි.
- ඉලෙක්ට්රොෆිලික ආදේශ ප්රතික්රියා වලදි බෙන්සින් වලයට සම්බන්ධ වි ඇති H පරමාණු ඉලෙක්ට්රොෆයිලය (E+) මගින් ආදේශ වේ. කිසියම් ඉලෙක්ට්රොෆයිලය (E+)ක් බෙන්සින් න්යෂ්ටිය මත සිදු කරන ඉලෙක්ට්රොෆිලික ආදේශ ප්රතික්රියාවක් පහත ලෙස දැක්විය හැක.
- මෙහි පලමු පියවර – කාබෝකැටායනයක් ලබා දිම සදහා බෙන්සින්වල C පරමාණුවක් හා ඉලෙක්ට්රොෆයිලය අතර බන්ධනයක් සැදිමයි.
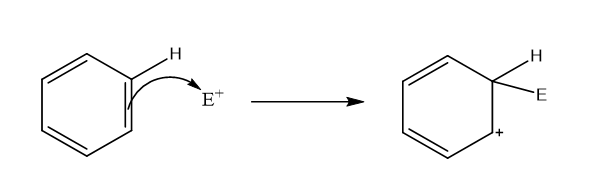
- මෙහිදි සෑදෙන අතරමැදි කාබෝ කැටායනයේ + ආරෝපණය විස්ථානගත විම මගින් ස්ථායි වේ.එසේ වන්නේ + ආරෝණය π බන්දන 2 සමග සංයුග්ම විම මගිනි. එය සම්ප්රයුක්තතාව මගින් පහත පරිදි පෙන්වා දිය හැක.
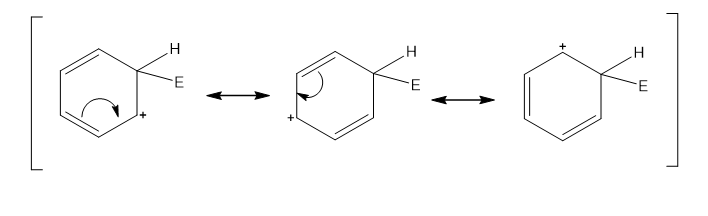
ඉහත කාබෝ කැටායනය සැදිමේදි π ඉලෙක්ට්රෝන වල ඇති චක්රීය විස්ථානගත විම බිදෙයි.
ඇරෝමැටික ස්ථායිතා ශක්තියද බිද වැටේ.
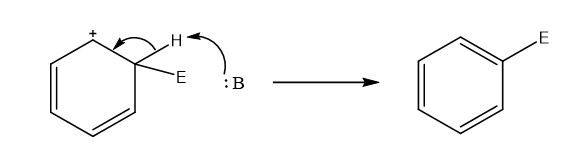
එම නිසා ශක්තිමය වශයෙන් ස්ථායි විමට අතරමැදි කාබෝකැටායනයෙන් ප්රෝටෝනයක් ඉවත් කර චක්රිය ලෙස විස්ථානගත වු ඉලෙක්ට්රෝන වලාව නැවත ස්ථාපිත කිරිමට යොමු වේ.
- ප්රෝටෝනයක් සාමාන්යයෙන් ලබා ගනුයේ ප්රතික්රියා මිශ්රණයේ ඇති එක් භෂ්මයක් මගිනි. එම නිසා ප්රතිඵලය වන්නේ බෙන්සින් වල H පරමාණුවක් වෙනුවට E ආදේශ විමයි.
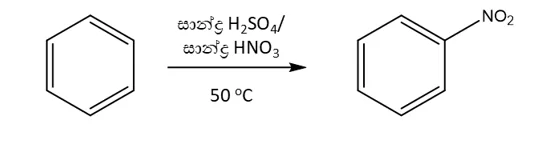
1.නයිට්රෝකරණය
- සාන්ද්ර HNO3 හා සාන්ද්ර H2SO4 මිශ්රණයක් ( නයිට්රොකරණ ) සමග බෙන්සින් උණුසුම් කල හොත් නයිට්රොබෙන්සින් සැදෙයි.
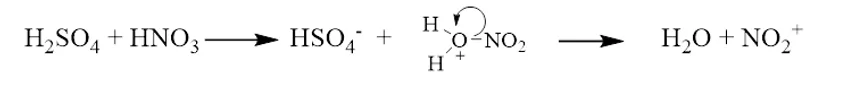
- සාන්ද්ර H2SO4 . සාන්ද්ර HNO3 ට වඩා ප්රබල අම්ලයක් ලෙස ක්රියා කරමින් එය ප්රොටෝනිකරණය (විජලනය) කිරිමත් එමගින් පහත පරිදි NO2+ අයනය (නයිට්රෝනියම් අයනය) සැදිමත් සිදු වේ. මෙහිදි ඉලෙක්ට්රොෆයිලය NO2+වේ.
- බෙන්සින් වල ඉලෙක්ට්රෝන වලාව වෙත ඇදෙන NO2+ අයනය C පරමානුව සමග සම්බන්ද වි බෙන්සොනයිට්රෝනියම් අයනය සාදයි.

- මාධ්යයේ ඇති HSO4– අයනය බෙන්සොනයිට්රෝනියම් අයනයෙන් ප්රෝටෝනයක් ඉවත් කිරිමෙන් ආදේශ ඵලයක් ලෙස නයිට්රොබෙන්සින් සාදයි.
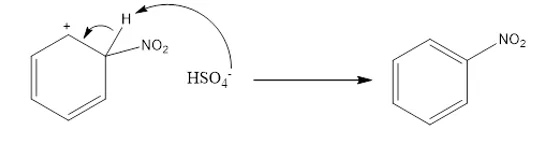
- H2SO4 මෙහිදී උත්ප්රේරකයක් ලෙස ක්රියා කරයි.යෙදූ ප්රමාණයම අවසානයේ ඉතිරි වේ.
2.ෆිඩ්ල්-ක්රාෆ්ට් ඇල්කයිල්කරණය
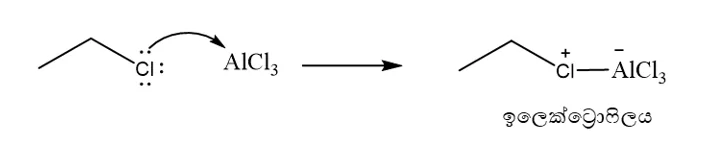
- නිර්ජල තත්ත්ව යටතේ ඇල්කිල් හේලයිඩ (R-X) ලුවිස් අම්ලයක් ( ex : AlCl3 ) සමග ප්රතික්රියා කරවිමෙන් ලැබෙන ඇල්කිල් කාබෝකැටායනය ( හෝ එහිදි සැදෙන ධ්රැවීය සංකීර්ණය ) ඉලෙක්ට්රොෆයිලය ලෙස ක්රියා කරමින් ඇල්කිල් කාබෝකැටායනය ඉලෙක්ට්රොෆිලික ආදේශ ප්රතික්රියාවක් සිදු කරයි.
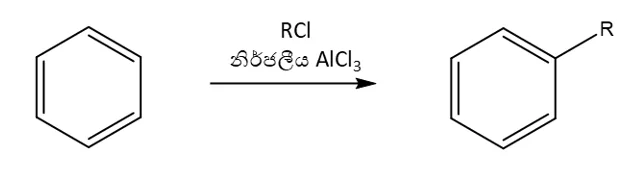
- R කාණ්ඩය ප්රාථමික ඇල්කිල් කාණ්ඩයක් වන විට ප්රතික්රියාව පහත ලෙස සිදු වේ. එවිට පහත සංකීර්ණය හරහා ප්රතික්රියාව සිදු වේ.
- R කාණ්ඩය ද්විතියික හෝ තෘතීයික ඇල්කිල් කාණ්ඩයක් වන විට වඩා ස්ථායි R+ කාබෝ කැටායනයක් ඇල්කිල් හේලයිඩ හා ලුවිස් අම්ලය අතර ප්රතික්රියාවෙන් ලැබේ.
- R+ ඉලෙක්ට්රොෆයිලය වේ.
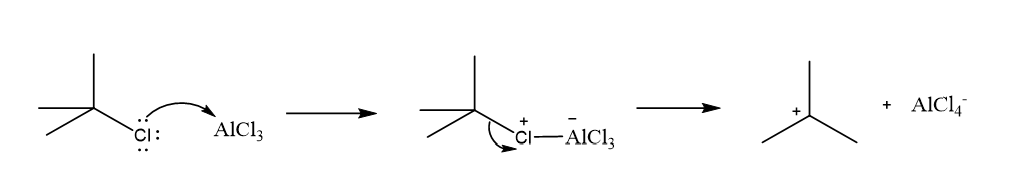
මෙහි යාන්ත්රණය,
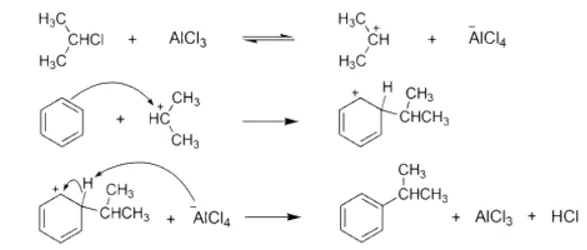
- අවසාන පියවරේදී ප්රෝටෝනයක් සමග ප්රතික්රියා කිරීමෙන් උත්ප්රේරකය නැවත ලැබේ.
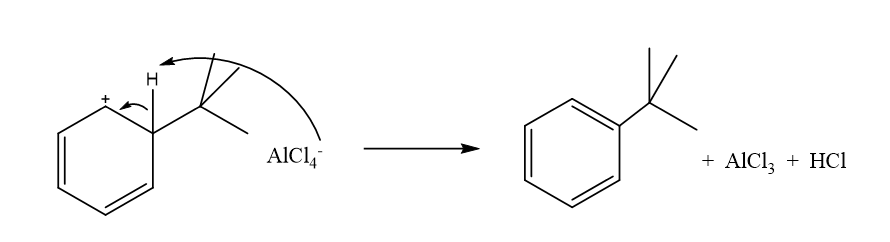
- අවසන් පියවරේදී [Alcl4]– ලුවිස් භෂ්මයක් ලෙසට ක්රියා කර ඇත.
- ඒක ආදේශක බෙන්සින් වල ආදේශක කාණ්ඩය හැලජනයට වඩා ප්රබල ලෙස ඉලෙක්ට්රෝන ආකර්ෂක කාණ්ඩයක් වන විට ෆිඩ්ල් -ක්රාෆ්ට් ඇල්කිල්කරණය සිදු නොවේ.
උදා:- Nitro benzene
Alcl3 උත්ප්රේරකයක් ලෙසටද ක්රියා කළ හැක.
- ලුවිස් අම්ලයක් ලෙස FeBr3 හෝ FeCl3 භාවිතා කල හැක.
3.ෆිඩ්ල්- ක්රාෆ්ට් ඒසයිල්කරණය
- නිර්ජල තත්ත්ව යටතේ ලුවිස් අම්ලයක් ( ex : AlCl3) හමුවේ බෙන්සින් අම්ල ක්ලෝරයිඩ සමග ඒසයිල් බෙන්සින් ලබා දෙයි. මෙහිදි H පරමාණුව ඒසයිල් කාණ්ඩයක් මගින් ආදේශ වේ.
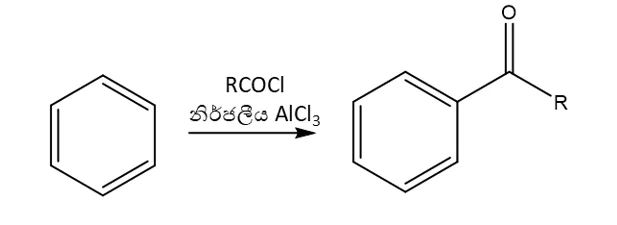
- මෙහි ඉලෙක්ට්රොෆයිලය වන්නේ ඒසයිල් අයනයයි. (RCO+). නිර්ජල තත්ව යටතේ ලුවිස් අම්ලයක් ( AlCl3) හමුවේ ඒසයිල් අයනය සැදෙන අයුරු පහත දැක්වේ.
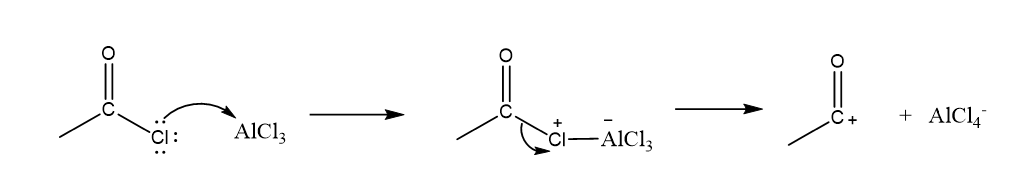
- ඒසයිල් අයනය බෙන්සින් සමග ප්රතික්රියාව මගින් ඇරිනියම් අයනයක් සාදයි.
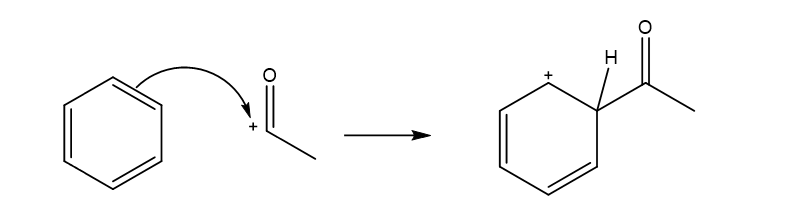
- ඇරෝමැටික ස්ථායිතා නැවත ලබා ගැනිමට ප්රෝටෝනයක් ඉවත් වේ.
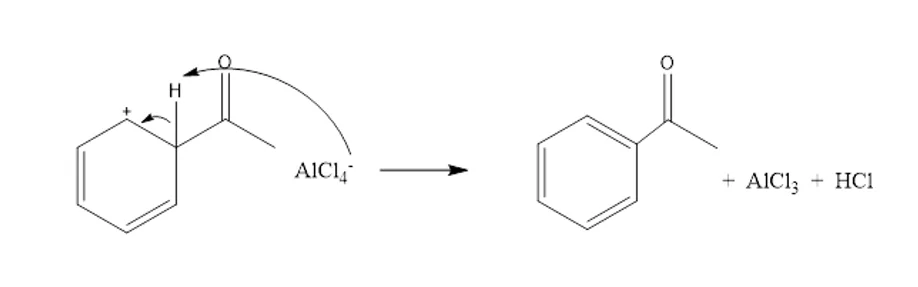
4.හැලජනීකරණය
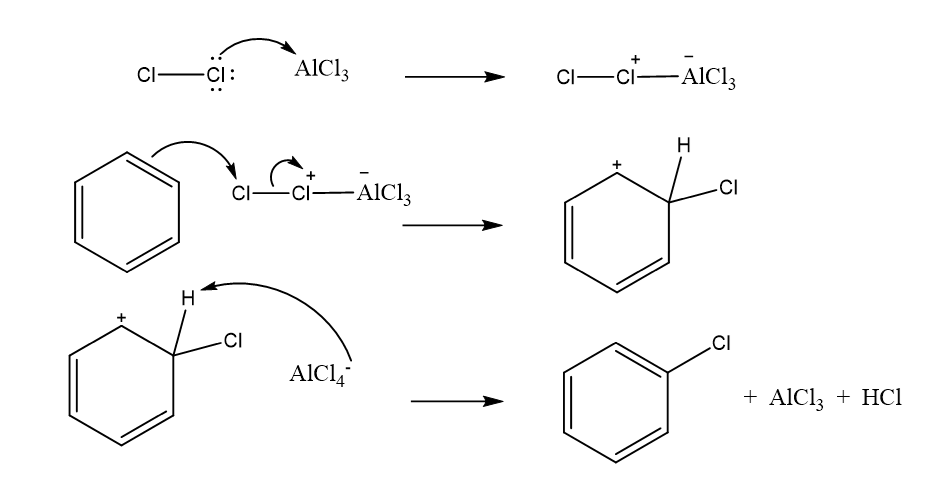
- ඩයිහැලජන් සමග හැලජන් වාහකයෙක් ලෙස ක්රියා කරන ලුවිස් අම්ලයක් (FeCl3 FeBr3 AlCl3 AlBr3 ) මෙහිදි යොදයි. මෙහිදි H පරමාණුවට හැලජනයක් ආදේශ වේ.
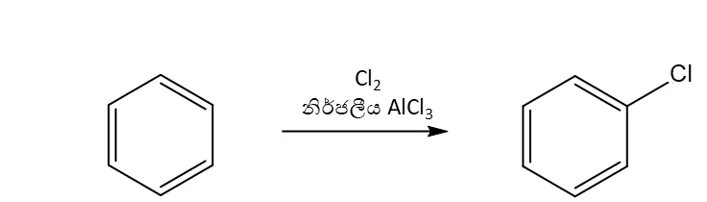
- හැලජනය x නම් මෙහි ඉලෙක්ට්රොෆයිලය වන්නේ x+ වේ.
- මෙහිදිද අවසාන පියවරේදි ඇරෝමැටික ස්ථායිතා නැවත ලබා ගැනිමට ප්රෝටෝනයක් ඉවත් වේ.
- මෙම ප්රතික්රියාව සදහා යාන්ත්රණය පහත පරිදි වේ.
බෙන්සින් වල ඔක්සිකරණය
- සම්ප්රයුක්තතාව මගින් බෙන්සින්වල π ඉලෙක්ට්රෝන වලාව ස්ථායි වි පවතියි. එමනිසා ආම්ලික KMnO4 වැනි ප්රබල ඔක්සිකාරක මගින්ද බෙන්සින් ඔක්සිකරණය කල නොහැක.
- නමුත් බෙන්සින් වලට කිසියම් C දාමයක් සම්බන්ද වු විට එය ඔක්සිකර්ණය වී බෙන්සොයික් අම්ලය සාදයි.
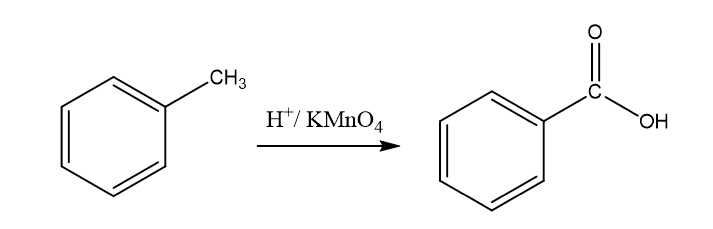
- ප්රාථමික හා ද්විතියික ඇල්කිල් කාණ්ඩ ඔක්සිකාරක හමුවේ ඉහත ලෙස ඔක්සිකරණය වී බෙන්සොයික් අම්ලය සාදයි.
- එම තත්ත්ව යටතේ තෘතියික ඇල්කිල් කාණ්ඩය ඔක්සිකරණය නොවේ.
- තෘතියිකඇල්කිල් කාණ්ඩය ඔක්සිකරණය වන තත්ත්ව යටතේ බෙන්සින් වලයද විච්ඡේදනය වේ.
බෙන්සින්වල ඔක්සිහරණය
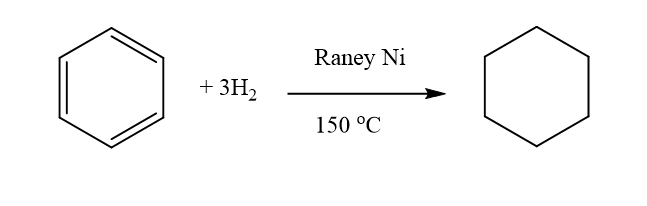
- π ඉලෙක්ට්රෝන වලාවෙ ස්ථායිතාව නිසා මෙම උත්ප්රේරක හයිඩ්රජනිකරනය ඇල්කීන හා ඇල්කයින වලදි තරම් පහසුවෙන් සිදු නොවේ. හේතුව නිශ්චිත ලෙස ස්ථානගත වි පවතින ද්විත්ව බන්ධන නොමැති විමයි.
- නමුත් උත්ප්රේරක ලෙස ප්ලැටිනම්, පැලේඩියම් හෝ රේනි නිකල් ඇති විට 150°C දි පමණ H2 ආකලනය කරමින් සයික්ලොහෙහෙන් ලබා දෙයි.
ඒක ආදේශිත බෙන්සින්වල ආදේශිත කාණ්ඩ වල යොමුකාරිත්වය
- බෙන්සින් වලට කුමන හෝ ආදේශකයක් සම්බන්ධ වූ විට එය ඇසුරෙන් බෙන්සින් වලය පහත ලෙස අංකනය කරයි.
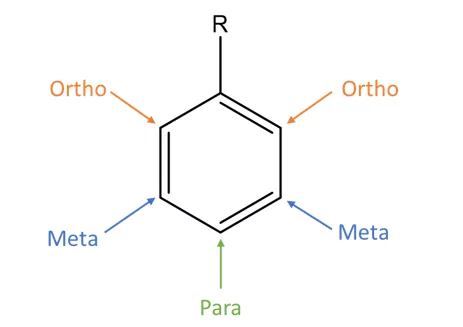
- ඒක ආදේශිත බෙන්සින් ඉලෙක්ට්රොෆිලික ආදේශ ප්රතික්රියාවලට සහභාගි වීමේ දෙවන ආදේශ කාණ්ඩය සම්බන්ධ වන ස්ථානය නිර්ණය කරනු ලබන්නේ පළමු ආදේශිත කාණ්ඩයේ ස්වභාවය අනුවය. ආදේශිත කාණ්ඩ මූලික ආකාර 2කට වර්ග කළ හැක.
ඕතෝ-පැරා යොමුකාරක කාණ්ඩ
බෙන්සින් වලට කිසියම් කාණ්ඩයක් පළමුව ආදේශ කාණ්ඩයක් පළමුව ආදේශ විමෙන් පසු දෙවන කාණ්ඩය ආදේශ වන්නේ ඕතෝ/ පැරා ස්ථානයට නම් පළමු ආදේශිත කාණ්ඩය ඕතෝ-පැරා යොමුකාරක කාණ්ඩ නම් වේ.
Eg:-
-OH
-R
-NH2
-NHR
-OCH3
හැලජන
-OCOR
-OR
-NHCOR (R-ඇල්කිල් කාණ්ඩ)
- මෙම කාණ්ඩවල බෙන්සින්ට කෙලින්ම බැදෙන පරමාණුවේ එකසර ඉලෙක්ට්රෝන යුගලයක් පවතියි.(ඇල්කිල් කාණ්ඩවලදී හැර)
- හැලජන හැර අනෙකුත් ඕතෝ-පැරා යොමුකාරක බෙන්සින් වලයේ ඉලෙක්ට්රෝන ඝනත්වය වැඩි කරමින් එය ඉලෙක්ට්රෝෆයිල කෙරෙහි ( බෙන්සින් වලට සාපේක්ෂව ) සක්රිය කරවයි. එවිට එය බෙන්සින් වලට වඩා ඉලෙක්ට්රෝන වලින් පොහොසත් වේ. එමනිසා ඒවා සක්රිය කාණ්ඩ නම් වේ.
- හැලජන වික්රිය කාණ්ඩ වේ. ඒවා බෙන්සින් වලයේ ඉලෙක්ට්රෝන ඝනත්වය අඩු කරමින් වලය ඉලෙක්ට්රෝෆයිල කෙරෙහි වික්රිය කරවයි.
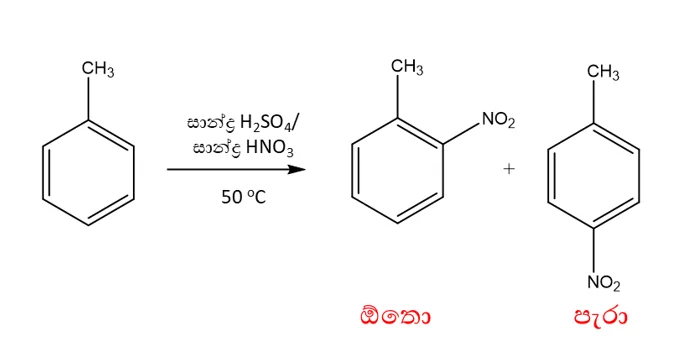
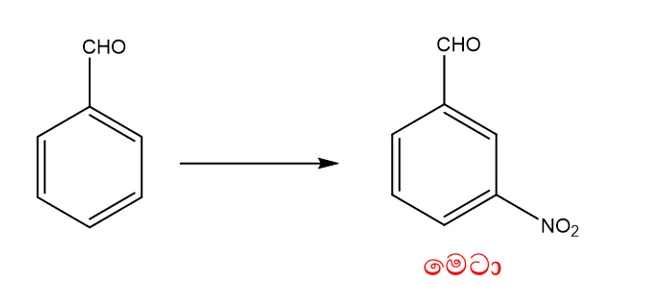
මෙටා යොමුකාරක කාණ්ඩ
- බෙන්සින් වලට කිසියම් කාණ්ඩයක් පළමුව ආදේශ කාණ්ඩයක් පළමුව ආදේශ විමෙන් පසු දෙවන කාණ්ඩය ආදේශ වන්නේ මෙටා ස්ථානයට නම් පළමු ආදේශිත කාණ්ඩය මෙටා යොමුකාරක කාණ්ඩ නම් වේ.
Eg:
-NO2
-CHO
-COR
-COOH
-COOR
-CN
-CONH2
-CONHR
- මෙටා යොමුකාරක කාණ්ඩ මගින් බෙන්සින් වලය ඉලෙක්ට්රෝෆයිල ආදේශය කෙරෙහි අක්රිය කරමින් බෙන්සින් වලයෙන් ඉලෙක්ට්රෝන ඉවතට ඇද ගනියි.
- බෙන්සින් වලය සක්රිය කරන කාණ්ඩ සියල්ල ඕතෝ-පැරා යොමු කාරක වේ. නමුත් ඕතෝ-පැරා යොමු කාරක සියල්ල බෙන්සින් වලය සක්රිය නොකරයි. ( හැලජන )
- මෙටා යොමුකාරක සියල්ල වික්රිය කාණ්ඩ වේ. නමුත් වික්රිය කාණ්ඩ සියල්ල මෙටා යොමුකාරක නොවේ. ( හැලජන )
- හැලජන ඕතෝ-පැරා යොමු කාරක වේ. නමුත් බෙන්සින් වලය වික්රිය කරයි.
සක්රිය කාණ්ඩ වල සක්රිය ප්රබලතාව
-NH2 > -NHR > -OH > -OR > -NHCOCH3 > -OCOCH3 > -R
වික්රිය කාණ්ඩ වල වික්රිය ප්රබලතාව
-NO2 > -CN > -CHO > – COCH3 > – COOH > -CONH2

