රසායනික කර්මාන්ත
රසායනික කර්මාන්තයක් ස්ථාපනයේදී සැපිරිය යුතු අවශ්යතා
- අමුද්රව්ය සැපයුම
- ප්රාග්ධනය
- බලශක්ති ස්වභාවය හා වියදම (පොසිල ඉන්ධන, සූර්ය ශක්තිය, න්යෂ්ටික ශක්තිය, ජෛව ස්කන්ධ )
- තාක්ෂණය
- ප්රවාහන පහසුකම් හා වෙළෙඳපොළ
- නිෂ්පාදන ක්රියාවලියේ සුරක්ෂිතතාවය
- අපද්රව්ය කළමනාකරණ ක්රමවේද
- කර්මාන්ත ස්ථාපනය කරන ප්රදේශය
- ඇතිවිය හැකි අනතුරු හා ඒවා වළක්වා ගැනීමේ ක්රම
- රජයේ නීති රෙගුලාසි හා ප්රතිපත්ති
- ශ්රමය
- අඛණ්ඩව පවත්වාගෙන යාම සඳහා වූ සුරක්ෂිතභාවය
- කර්මාන්ත ආශ්රිතව ජනනය වන පාරිසරික දූෂක පරිසරයට එක්වීම වැළැක්වීමට ගත හැකි උපාය මාර්ග
රසායනික කර්මාන්ත සඳහා අමුද්රව්ය භාවිතය
- ස්වභාවික සම්පත් කර්මාන්තයක අමුද්රව්යයක් ලෙස යොදා ගැනීමේදී සලකා බැලිය යුතු ලක්ෂණ ,
- දීර්ඝකාලීන ප්රයෝජනයට ගත හැකි විශාල සංචිත ලෙස පැවතීම
- ප්රවේශ පහසුව
- ඉහළ සංශුද්ධතාවය
නිෂ්පාදන සඳහා යොදාගනු ලබන අමුද්රව්ය කිහිපයක්
1) වාතය
- යකඩ නිස්සාරණය, නයිට්රික් අම්ලය හා sulfuric අම්ලය නිෂ්පාදනය සඳහා ක්රියාකාරී සංරචකයක් ලෙස O2 අවශ්ය වේ.
- N2 ලබාගත හැකි ස්වභාවික ප්රභවයක් ලෙස වායුගෝලීය වාතය භාවිතා කරයි.
2) ජලය
- NaOH , නයිට්රික් අම්ලය , සල්ෆියුරික් අම්ලය හා Ca(OH)2 නිෂ්පාදනයට ජලය යොදා ගනී .
3) NaCl
- රොක් සෝල්ට් ලෙස වූ නිධි මගින් NaCl ලබා ගැනීමටත් , කෝස්ටික් සෝඩා නිෂ්පාදනයටත් , Na ලෝහය නිස්සාරණයට අමුද්රව්යක් ලෙසත් මුහුදු ජලය යොදා ගනී.
- රොක් සෝල්ට් නිධි මඟින් NaCl ලබා ගැනීමටත්, එම NaCl ම්ඟින් කෝස්ටික් සෝඩා නිපදවීම හා Na ලෝහය නිස්සාරණය කරයි.
- NaCl නිස්සාරණයට මුහුදු ජලය ප්රභවයක් වුවද, කෝස්ටික් සෝඩා නිෂ්පාදනයට මුහුදු ජලය අමුද්රව්යක් ලෙස භාවිතා කළ නොහැක.
4) ඛනිජ
- යකඩ, තඹ, නිකල්, ඇලුමිනියම්, ටයිටේනියම් වැනි ලෝහ නිස්සාරණයට, ඒ ලෝහ අන්තර්ගත ඛනිජ වර්ග අමුද්රව්ය ලෙස යොදා ගනු ලැබේ .
5) ගල් අඟුරු
- ඉන්ධනයක් ලෙස ප්රධාන වශයෙන් භාවිතා කරයි. යකඩ නිස්සාරණයේ දී ඉන්ධනයක් ලෙසත්, සෘජු ඔක්සිහාරකයක් ලෙසත්, ප්රධාන ඔක්සිහාරකයක් වන CO ජනනයට අවශ්ය අමුද්රව්යයක් ලෙසත් යොදා ගනී .
6)බොරතෙල්
- පෙට්රල් ඩීසල් වැනි ඉන්ධන සඳහා ප්රධාන ප්රභවය ලෙස බොර තෙල් භාවිතා කරයි.
- බහුඅවයවික සඳහා අවශ්ය වන ඒක අවයවික, ඖෂධ හා මූලික කාබනික සංයෝග නිෂ්පාදනය සඳහා අමුද්රව්ය ලබා ගන්නා ප්රභවය බොරතෙල් වේ .
7) ශාක
- විවිධ තෙල් වර්ග ,ක්ෂීර( රබර් කිරි), රෙසින හා ඖෂධ නිෂ්පාදනයට ශාක වැදගත් සම්පතකි .
රසායනික කර්මාන්ත පිළිබඳ හැදින්වීම හා අමුද්රව්ය භාවිතය
s ගොනුවේ මූලද්රව්ය ආශ්රිත රසායනික කර්මාන්ත
Mg නිස්සාරණය
ඩව් (dow) ක්රමය
- Mg අඩංගු ඛණිජ පෘථිවි කබොලේ බහුලය. නමුත් මුහුදු ජලය මගින් Mg නිස්සාරණය කිරිම වඩාත් පහසුය. ලාභදායකය.
- මුහුදු ජලයේ ලවණ පිහිටන ප්රතිශතය NaCl > MgCl2 > MgSO4 > CaSO4 ලෙස අඩුවේ.
- මුහුදු ජලයේ බර අනුව 0.13% පමණ Mg අඩංගු වේ.
- ලුණු නිෂ්පාදනයේ 03 තාටාකයේ ඉහලින්ම සෑදෙන ඉවතලන ද්රාවණය බිටර්න් ද්රාවණය වේ . ( මව් ද්රාවණය ලෙසද හැදින්වේ )
- මෙහි සැලකිය යුතු ලෙස Mg අන්තර්ගතවේ. ඒනිසා Mg නිසාරණයට බිටර්න් ද්රාවණය සුදුසු වේ.
- Mg නිස්සාරණය පියවර 4ක් යටතේ සිදු කරයි.
පළමු පියවර
- පළමුව හුනුගල් තාප වියොජනය කර CaO නිපදවා ගනි. ( මෙය ප්රධාන අරමුණ වේ )
- මේ සදහා ඩොලමයිට් ඛණිජයද යොදා ගත හැක.(ශ්රී ලංකාවේ ඩොලමයිට් බහුලය )
CaCO3(s)⇌ CaO(s) + CO2(s)
CaCO3 (s)+ MgCO3(s) ⇌ CaO(s)+ MgO(s) + 2CO2(g)
- මෙහිදි ප්රතික්රියාව ප්රථ්යාවර්ත නිසා CO2 කාර්යක්ෂමව ඉවත් කිරිමට හැකිවන ලෙස ක්රියාවලිය සැලසුම් කල යුතුය. එවිට තාප වියොජන ක්රියාවලියේ එලදායිතාවය වැඩි වේ.
- ලැබෙන CaO ආශ්රිතව CaCO3 අපද්රව්යය ලෙසට පැවතීම අවාසියකි.
දෙවන පියවර
- මේ පියවරේ ප්රධාන අරමුණ Mg2+ අඩංගු ද්රාවණයෙන් Mg(OH)2 නිපදවා ගැනිමයි.
- පලමු පියවර මගින් නිපදවාගත් ඔක්සයිඩ ( CaO හා MgO, ඩොලමයිටට් යොදා ගත්තේනම් MgO ලැබේ.) බිටර්න් ද්රාවණය සමග ප්රතික්රියා කරවනු ලැබේ.
- එහිදි ජලය සමග CaO ප්රතික්රියා කිරිමෙන් Ca(OH)2 සැදේ.
- මේ Ca(OH)2 මද වශයෙන් ජල ද්රාවණය වි Ca2+ හා OH– අයන ලබාදේ. Mg(OH)2 හි ද්රව්යතා ගුණීතය Ca(OH)2 හි ද්රව්යතා ගුණිතයට වඩා කුඩා නිසා Ca(OH)2 මගින් ලැබෙන OH– අයන මගින් ද්රාවණයේ වු Mg2+ අයන Mg(OH)2 ලෙස අවක්ෂේප වීම සිදු වේ.
- ඒ සමගම තව තවත් Ca(OH)2 ද්රාවණය වෙමින් OH– අයන නිදහස් කිරිම සිදු වේ. ඒ් අනුව Ca(OH)2 අවක්ෂේප වශයෙන් ඉතිරි විමක් නොමැතිව ද්රාවණය වේ.
- මෙහිදි Mg(OH)2 සමඟ Ca(OH)2 අවක්ෂේප තිබීම අවාසියකි.
CaO(s) + H20(l) ⇌ Ca(OH)2(s)
Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Mg2+(aq) + 2OH–(aq) ⇌ Mg(OH)2(s)
තෙවන පියවර
- මෙහිදි ඉහත සෑදෙන අවක්ෂේප පෙරා HCl සමග ප්රතික්රියා කරවා MgCl2 සැදිම අරමුණ වේ.
Mg(OH)2(s) + 2HCl(aq) ⇌ MgCl2(s) + 2H2O(l)
- මෙහිදි ඩොලමයිට් භාවිත කළේ නම් CaO හා MgO ඇති විට CaO ඉහත පරිදිම ජලිය ද්රාවණයේ MgO ඉවත් කිරිමට දායක වේ.
සිව්වන පියවර
- ඉහත ක්ලොරයිඩයේ ජලිය ද්රාවණය රත් කර ජලය වාෂ්ප ලෙස ඉවත් කර MgCl2 ස්ඵටිකය ජලය ඉතා අඩු ප්රමාණයක් පවතින පරිදි පිලියෙල කරගනි. එනම් වියලි ලවණය ලබා ගනී. (නමුත් 16% පමණ ජලය ඇත. )
- ඉහත සඑටික ඝනය ඩව් කෝෂය තුලට ඇතුලත් කර ගනි. එහිදි විලීන ද්රාවණයක් සාදා පසුව විද්යුත් විච්ජේදනය කරනු ලැබේ.
- ලවණය විලීන කිරිම සදහා රත් කරන විට එහි වු ජලය සහමුලින්ම වාශ්ප වි ඉවත් වේ. කෝෂය තුල උෂ්ණත්වය 700-800 0C පරාසයක පවත්වා ගැනේ.
- මැග්නිසියම් ක්ලොරයිඩයේ ද්රවාංකය 7140C හා මැග්නිසියම් ලෝහයේ ද්රවාංකය 6500C පමණ නිසා ඉහල උෂ්ණත්වයක පවත්වා ගත යුතුය.
- විලීන ලවණය විද්යුත් විච්ජේදනය කරන විට ප්රතිඑල වන Mg ලෝහය ද්රව අවස්ථාවෙ පවතින නිසා ඉවතට ගැනිම පහසුය.
- Mg හි ද්රවාංකය MgCl2 වල ද්රවාංකයට වඩා අඩු නිසා සැදෙන Mg උඩ පාවේ.
- Mg හි ද්රවාංකයේ දී Mg හි ඝනත්වය 1.548gcm-3 ද විලීන MgCl2 හි 1.68gcm-3 ඝනත්වය බැවින් Mg හි ඝනත්වය MgCl2 හි ඝනත්වයට වඩා අඩු වන නිසා Mg, MgCl2 හි පාවේ.
- මෙහිදි ඩව් කෝෂයේ ඇනෝඩය ලෙස මිනිරන් ඇනෝඩයකුත් කැතෝඩය ලෙස වානේ කැතෝඩයකුත් භාවිතා කරයි.
- ඇනෝඩ ප්රතික්රියාව පහත ලෙස වේ.
2Cl–(aq) → Cl2(g) + 2e
- කැතෝඩ ප්රතික්රියාව පහත ලෙස වේ.
Mg2+(aq) + 2e → Mg(l)
- මෙහිදි ක්ලොරින් වායුව පිටවන අතර නැවත HCl සැදිමට යොදාගනි.
- කැතොඩය අසල ද්රව Mg සැදේ.
- මෙහිදි, වානේ කැතෝඩය නිසා 99.8% ඵලදාවකින් යුක්තව Mg නිස්සාරණය කරගත හැක.
Mg වල ප්රයෝජන
- ගුවන්යානා හා වාහන සදහා අවශ්ය සැහැල්ලු මිශ්ර ලෝහ නිශ්පාදනයට Mg යොදා ගනී
- Mg නිපදවන විද්යුත් රසායනික කෝෂයේ හරස්කඩක් පහත දැක්වේ.

ඩව් ක්රමය මගින් Mg නිෂ්පාදනය
කෝස්ටික් සෝඩා(NaOH) නිෂ්පාදනය
- බ්රයින් (පිරිසිදු සාන්ද්ර NaCl) ද්රාවණයක් විද්යුත් විච්චේදනය මඟින් NaOH නිපදවයි .
NaCl(s) + ජලය → NaCl(aq)
2NaCl(aq) + 2H2O(l) → NaOH(aq) + H2(g) + Cl2(g)
- මෙහිදී අතුරුඵල ලෙස Cl2 වායු මෙට්රික් ටොන් එකක් පමණ ද H2 වායු 30kg පමණද ලැබේ .
- ඒවාගේ මවුල ප්රමාණ සෛද්ධාන්තිකව සමාන වුවත් Cl2 සුළු වශයෙන් ජලය දිය වන නිසා වායු ලෙස එකතු කරගත හැකි Cl2 මවුල ප්රමාණය H2 වලට වඩා මදක් අඩුවේ.
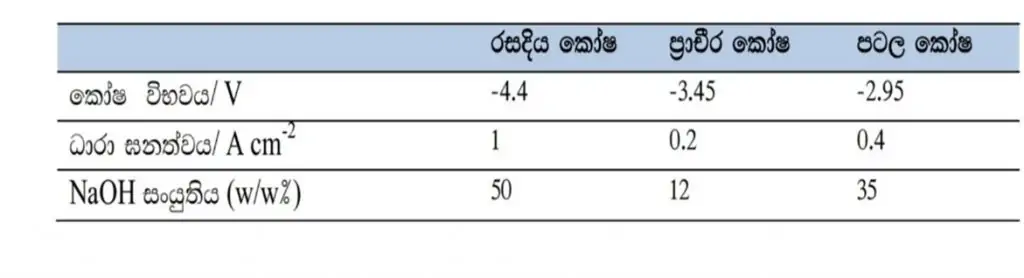
- මෙම විද්යුත් විච්ඡේදනය සඳහා භාවිතා කරන කෝෂ ක්ලෝරො ඇල්කලි කෝෂ නම් වේ .ඒවා වර්ග තුනකි .
- රසදිය කෝෂ
- ප්රාචීර කෝෂ
- පටල කෝෂ
රසදිය කෝෂ ක්රමයේ අවාසි 2 කි. ඒවා නම්,
- රසදිය පරිසරයට නිදහස් වීම.
- NaOH ආශ්රිතව ස්වල්ප ලෙස රසදිය තිබීම වේ .
ප්රාචීර කෝෂ ක්රමය
- ඇනෝඩය හා කැතෝඩ ඇස්බැස්ටෝස් ප්රාචීරයකින් වෙන් වේ .
- එහි ඇනෝඩ කුටීරයේ ද්රව මට්ටම කැතෝඩ කුටීරයේ එම මට්ටමට වඩා වැඩිය .
- එම නිසා ප්රාචීරය හරහා ඇනෝඩ කුටියේ සිට කැතෝඩ කුටීරයේ දෙසට ද්රවස්ථිතික පීඩනයක් ඇතිවේ .
- එම නිසා ඇනෝඩයේ සිට කැතෝඩය දෙසට Na+ අයන එම පීඩනයේ බලපෑම යටතේ ගමන් කරයි .
- එසේම කැතෝඩයේ සිට ඇනෝඩය දෙසට OH– අයන සංක්රමණය වීම එමගින් වළකයි .
- කෝෂ වර්ග තුනෙහි භෞතික ගුණාංග සංසන්දනයක් පහත දැක්වේ .
පටල කෝෂ ක්රමය
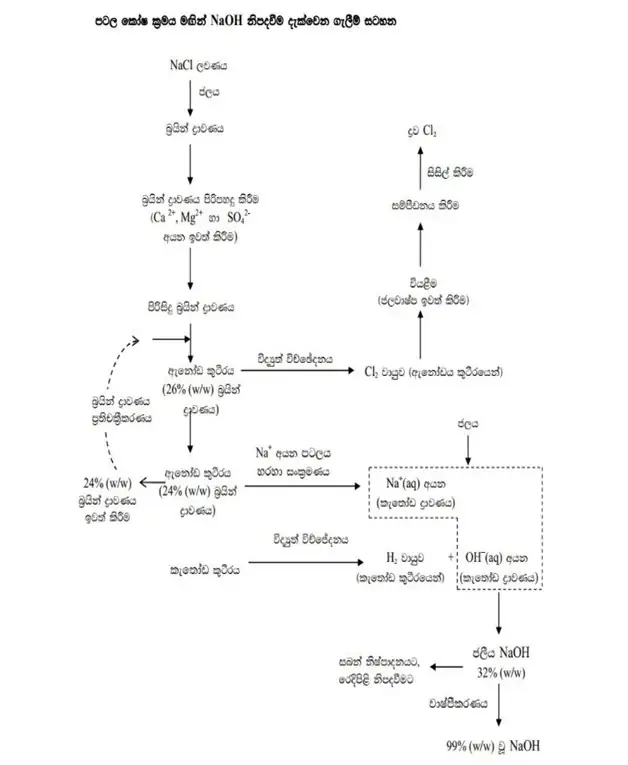
- මෙමගින් ලැබෙන NaOH හි සංශුද්ධතාව ඉහළය .වැයවෙන විද්යුත් ප්රමාණය අවම වන අතර පරිසර හානිය ද අවමය.
- මෙහිදී ඇනෝඩය හා කැතෝඩය ධන අයන වලට පාරගම්ය පටලයකින් වෙන්වී ඇත .
- මෙහිදී යොදා ගන්නා බ්රයින් ද්රාවණයේ Ca2+, Mg2+, SO42- අයන අවම විය යුතුය .
- නැතහොත් ද්රාවණය භාෂ්මික වීමේදී මෙම අයන අවක්ශේප වී කෝෂයේ ක්රියාකාරිත්වයට බාධා කරයි .
- එසේම ඒවා NaOH ද්රාවණයට එකතුවී කෝස්ටික් සෝඩාවල සංශුද්ධතාවය අඩු කරයි.
- මෙහිදී බ්රයින් ද්රාවනයේ ඇති අපද්රව්ය පහත පරිදි ඉවත් කරයි.
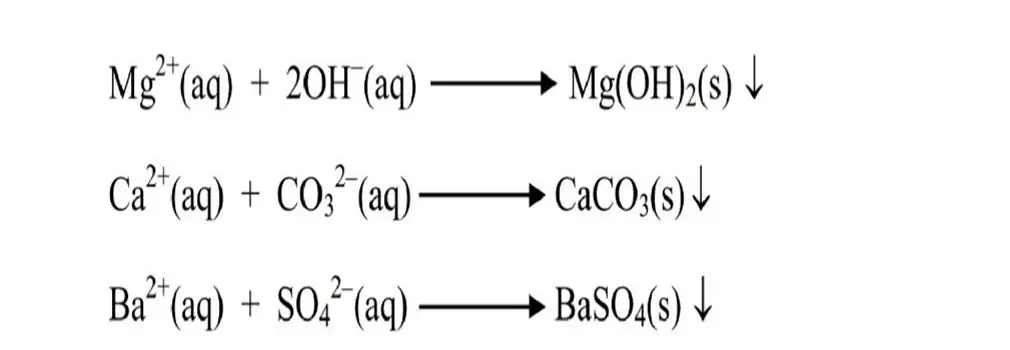
- BaCl2 එක් කර SO42- අයන BaSO4 ලෙස අවක්ශේප කර ඉවත් කරයි.
- NaOH හා Na2CO3 එක් කර Mg2+ හා Ca2+ අයන Mg(OH)2 හා CaCO3 ලෙස අවක්ෂේප කර ඉවත් කරයි.
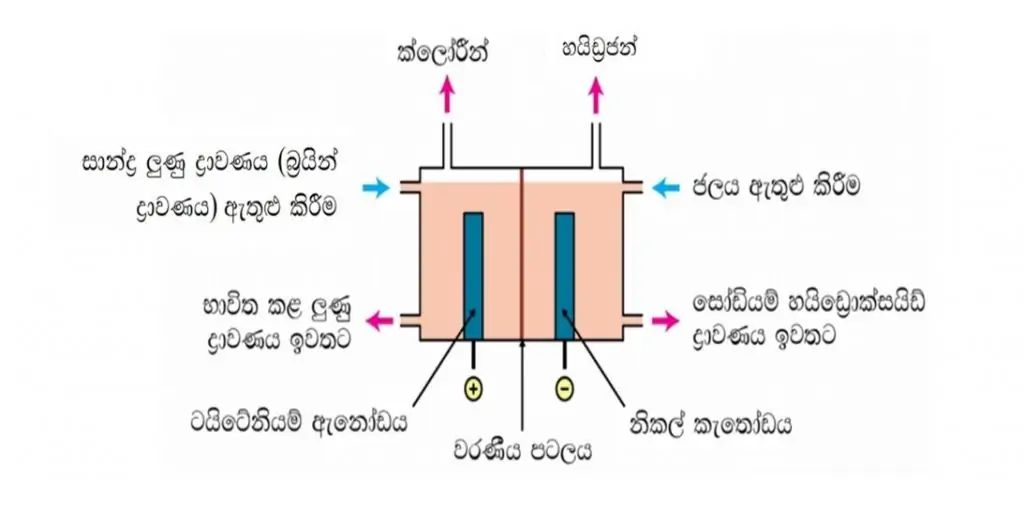
රූපය- පටල කෝෂය
- ඇනෝඩ කුටීරයේ Na+ හා Cl– අයන ද , ජලය විඝටනයෙන් ලැබෙන H+ හා OH– අයනද සුළු වශයෙන් ද ඇත.
- OH– අයන ඔක්සිකරණයෙන් O2 නිපදවීමට ලබාදිය යුතු සම්මත විද්යුත් විභවය 0.4V වේ.
- Cl– අයන ඔක්සිකරණයෙන් Cl2 නිපදවීමට ලබාදිය යුතු සම්මත විද්යුත් විභවය 1.36 V වේ.
- මෙම නිසා Cl2 වලට අමතරව O2 ද නිදහස් විය හැක .
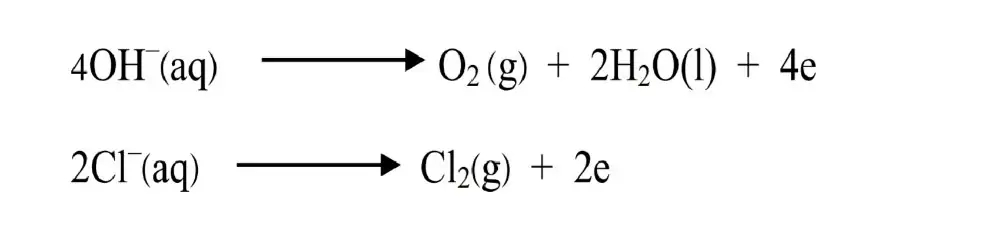
- මෙය වැළැක්වීමට ඉතා සාන්ද්ර NaCl (බ්රයින්) ද්රාවණයක් යොදාගනී .
- එවිට Cl– ට සාපේක්ෂව OH– අයන ඉතා අඩු බැවින් OH– ඔක්සිකරණය වී O2 නිදහස් වීමේ සම්භාවිතාව ඉතා අඩුයි .
- විද්යුත් විච්ඡේදනය වීමේදී Cl– අයන අඩුවන බැවින් OH– ඔක්සිකරණය වීමේ සම්භාවිතාවක් ඇත .
- එබැවින් බ්රයින් ද්රාවණය සම්පූර්ණයෙන්ම විද්යුත් විච්ඡේදනය නොකරන අතර, අඛණ්ඩව බ්රයින් ද්රාවණය ඇනෝඩ කුටීරයට පොම්ප කරන අතර ඇනෝඩ යෙන් ඉවත් කිරීමද සිදුවේ .
- විද්යුත් විච්ඡේදනය සිදුවන විට ඇනෝඩ කුටීරයේ Cl– සාන්ද්රනය අඩු වේ නමුත් Na+ සාන්ද්රනය අඩු නොවේ .
- මෙවිට කෝෂය තුළ විද්යුත් උදාසීනතාව පවත්වා ගැනීමට Na+ අයන වරණීය පාරගම්ය පටලය හරහා කැතෝඩය ට ගමන් කරයි .
- ජලීය Na+ ට වඩා පහසුවෙන් H+ අයන ඔක්සිහරණය වේ. ආරම්භයේ දී කැතෝඩය තුළ H+ අයන ඇත .
- එමනිසා පහසුවෙන් H+ අයන H2 ලෙසට ඔක්සිහරණය වේ .
- එවිට ජලය විඝටන සමතුලිතය බිඳ බිඳ වැටී දිගින් දිගටම විඝටනය වෙමින් OH– නිදහස් කරයි .
- මෙවිට කැතෝඩ යේ OH– සාන්ද්රනය ඉහළ යයි .
- ජලයේ විඝටන සමතුලිතය පහත පරිදි වේ .
H2O(l) ⇌ H+(aq) + OH–(aq)
- එම සමතුලිතය බිඳවැටී ඇති අවස්ථාව පහත පරිදිය .
H2O(l) → H+(aq) + OH–(aq)
- ඇනෝඩය තුළ Cl2 සෑදෙන සීඝ්රතාවය ට සමාන සීඝ්රතාවයකින් කැතෝඩය තුළ H2 සෑදෙන බැවින් සමස්තයක් ලෙස සැලකූ විට පද්ධතිය විද්යුත් උදාසීන වේ.( Cl– අඩුවන ශීඝ්රතාවයට සමානව OH– ජනනය වෙන බැවිනි )
- විද්යුත් විච්ඡේදනයේදී ඇනෝඩ කුටීරයේ කුටීරයේ Cl– සාන්ද්රණය අඩු වුවත් Na+ අයන සාන්ද්රණය අඩු නොවේ.
- තවද කැතෝඩ කුටීර තුලද H+ ඔක්සිහරණය වන බැවින් OH– සාන්ද්රණය වැඩිවේ.
- එවිට පටලය හරහා OH– අයන ඇනෝඩය දෙසට සංක්රමණය වුවහොත් එහි ඇති Cl2 හා OH– ප්රතික්රියා විය හැක.
- එහෙත් පටලය ඍණ අයන වලට පාරගම්ය නැති බැවින් මෙය වැළකේ.
- නමුත් එම පටලය ධන අයන සදහා පාරගම්ය බැවින් Na+ කැතෝඩ කුටීරයට සංක්රමණය වී විද්යුත් උදාසීනතාවක් ඇති කරයි.
- එබැවින් කැතෝඩයෙන් වෙන් කරගන්නා ද්රාවණයේ Na+ හා OH– (NaOH(aq)) ඇත.
- එසේම පටලය හරහා Cl– අයන වලට ගමන් කළ නොහැකි නිසා NaOH සමග අපද්රව්යක් ලෙස NaCl මිශ්ර නොවේ.
ඇනෝඩ ප්රතික්රියාව (ධන අග්රය)
2Cl–(aq)→ Cl2(g) + 2e
කැතොඩ පරතික්රියාව (ඍණ අග්රය)
2H2O(l) + 2e →2OH–(aq) + H2(g)
සමස්ත ප්රතික්රියාව
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
- පටල කෝශයේ ඇනෝඩ හා කැතෝඩ කුටීර වෙන් කරන පාරගම්ය පටලයේ ඉතා කුඩා සිදුරු ඇති අතර එම සිදුරු මායිම ආශ්රිතව ඍණ අයන ඇත.
- එහෙයින් ඒ සිදුර අවට අවකාශයේ ඍණ විද්යුත් ක්ශේත්රය මගින් ධණ අයන ආකර්ශණය කරන අතර ඍණ අයන විකර්ශණය කරයි.
- කෝශයේ ඇනෝඩය ටයිටේනියම් වලින්ද, කැතෝඩය නිකල් වලින්ද නිපදවා ඇත.
- පටල කෝශයෙන් අඛණ්ඩව NaOH නිපදවිය හැක.
- අඛණ්ඩව 26% සාන්ද්රණය ඇති බ්රයින් ඇනෝඩ කුටීරයට එක් කරන අතර 24% පමණ වූ බ්රයින් ද්රාවණය එයින් ඉවත් කරයි .
NaOH වල ප්රයෝජන
- සබන් නිශ්පාදනය
- කඩදාසි කෘතිම සේද හා සායම් කර්මාන්තය
- ප්රභල භශ්මයක් ලෙස භාවිතා කිරීම
- අපජලය පිරියම් කිරීමේදී බැරලෝහ ඒවායේ හයිඩ්රොක්සයිඩ ලෙස අවක්ෂේප කිරීම.
Cl2 වල ප්රයෝජන (NaOH නිශ්පාදනයේ අතුරුඵල)
- රෙදිපිලි ,දැව හා කඩදාසි පල්ප විරංජනය කිරීම
- පානීය ජලයේ බැක්ටීරියා විනාශ කිරීම
- HCl නිශ්පාදනය
- ක්ලෝරිනීකෘත රබර් , සායම්, කෘමිනාශක හා ඖෂධ නිපදවීම
- PVC වැනි බහුඅවයවක ද්රව්ය නිපදවීමට අවශ්ය වයිනයිල් ක්ලෝරයිඩ් නිපදවීම
H2 වල ප්රයෝජන( NaOH නිශ්පාදනයේ අතුරුඵල)
- NH3 නිපදවීම
- HCl නිපදවීම
- එලවලු තෙල් හයිඩ්රජනීකරණයෙන් මාගරින් නිපදවීම
- ඉන්ධනයක් ලෙස භාවිතා කිරීම
Na2CO3 /NaHCO3 නිපදවීම
- මුහුදු ජලය (බ්රයින් ද්රාවණය) හුනුගල් (CaCO3) හා NH3 යොදා නිවුන් අටලු පද්ධතියක් මත පදනම්ව Na2CO3 නිපදවිමට භාවිතා වන ඇමෝනියා සෝඩා ක්රමය හෙවත් සෝල්වේ ක්රමය පිළිබදව මෙහිදි සාකච්ඣඡා කෙරේ.
නිපදවීමේ ක්රියාවලිය
01. ඇමෝනීකරණය
- නිවුන් අටලු පද්ධතියේ වන පලමු අටලුවේ ඉහලින් NaCl ද්රාවණය(පිරිසිදු බ්රයින් ද්රාවණය) එකතු කරන අතර පහලින් NH3 යන මුලික අමුද්රව්ය එකතු කරයි. NaCl හා NH3 එකතු විමෙන් NH3 වලින් සන්තෘප්ත වූ NaCl ද්රාවණය ලැබිම පලමු පියවරේදි සිදුවේ.
- මෙසේ ප්රතිවිරුද්ධ දිශා වලට ප්රතික්රියක එවිම මගින් ඒවා කාර්යක්ෂමව මිශ්ර විමට සැලැස්විම ප්රතිප්රවාහ ක්රමය ලෙස හදුන්වයි.
- NaCl හා NH3 එකතු විමෙන් NH3 වලින් සන්තෘප්ත වූ NaCl ද්රාවණය ලැබිම පලමු පියවරේදි සිදුවේ.
- බ්රයින් ඇමෝනීකරණය තාපදායක ක්රියාවලියකි.
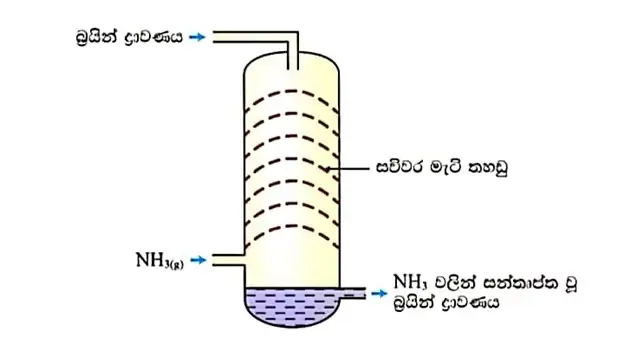
රූපය – ඇමෝනීකරණ අටලුව
02. කාබොනීකරණය
- පලමු පියවරෙදි ලැබෙන NH3 වලින් සන්තෘප්ත වූ NaCl ද්රාවණය දෙවන අටලුවේ ඉහලින් එකතු කරන අතර CaCO3 තාප වියෝජනයෙන් පිලියල කරන CO2 එම අටලුවේ පහලින් එකතු කරයි.සන්තෘප්ත ද්රාවණය හා CO2 ප්රතික්රියාවෙන් HCO3–(aq) දෙවන අටලුවේ ජනිත වේ.
NH3 (g) + H2O(l) ⇌ NH4+( aq) + OH–(aq)
OH– (aq) + CO2(g) → HCO3-(aq)
- මෙලෙස ලැබෙන ජලීය HCO3– අයන මුහුදු ජලයේ තිබෙන Na+(aq) සමග එකතු විම NaHCO3 නිපදවිම සදහා පසුබිම සලසයි.
- මෙම ප්රතික්රියාව ද තාපදායක වේ.
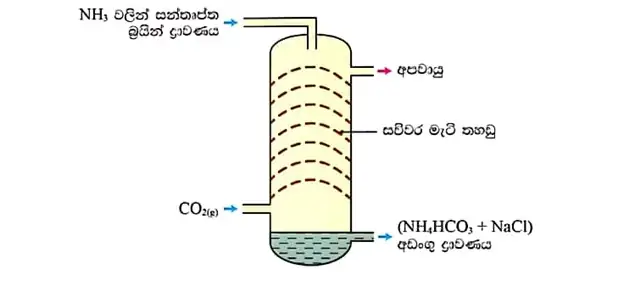
රූපය-කාබොනීකරණ අටලුව
- සැදෙන HCO3–(aq) අයන මගින් OH– ප්රතිග්රහණය නිසා සමතුලිතය වඩා ඉදිරියට නැඹුරු වි දෙවන අටලුව තුළ [HCO3–(aq)] ඉහළ යාම දක්නට ලැබේ.
03. NaHCO3 (s) වෙන් කර ගැනීම
- දෙවන අටලුවේ ජනිත වන ඉහල [HCO3–] නිසා දෙවන අටලුවේ අවසාන අන්තයේදී NaHCO3 ස්ඵටිකීකරණය වේ.
Na+ (aq) + HCO3-(aq) → NaHCO3(s)
- ඒ අනුව ක්රියවලියේ සමස්ත ප්රතික්රියාව පහත අයුරු ලිවිය හැකිය.
NaCl(aq) + NH3(g) +CO2(g)+H2O(l) → NaHCO3(s) +NH4Cl(aq)
- මෙලෙස ලැබෙන NaHCO3 තාප වියොජනයෙන් අවශ්ය පරිදි Na2CO3 පිලියල කර ගනි.
- වෙන් කර ගන්නා NaHCO3 අධික ලෙස රත් කිරීමෙන් නිර්ජල Na2CO3 ලබා ගනී. සැදෙන CO2 වායුව නැවත කබොනීකරන අටලුව වෙත යැවේ.
2NaHCO3(S) → Na2CO3(s) + CO2(g)+H2O(l)
ක්රියාවලි ප්රශස්තීකරණය
- පලමු අටලුවේ දී පහලින් එකතු කරන NH3(g) සහ දෙවන අටලුවේ පහලින් එකතු කරන CO2 වායුව දිය වීමේ ක්රියාවලිවල කර්යක්ශමතාවය ඉහල නැංවීම පිනිස අඩු උෂ්ණත්ව සහ ප්රතිප්රවාහ මූලධර්මය යොදා ගැනේ.
- පළමු අටලුවේ දී බ්රයින් ඇමෝනීකරණය වීම ද, දෙවන අටලුවේ දී ඇමෝනීකරණය කළ බ්රයින් ද්රාවණයේ CO2 දිය වීම ද, NH4OH සමග ජලීය CO2 ක්රියා කර NH4HCO3 ලබා දීමක් ද තාප දායක බැවින් එසේ අටලු 2ම අඩු උෂ්ණත්වයක් පවත්වා ගනී.
- දෙවන අටලුවේ අවසාන අන්තයේදී අඩු උෂ්ණත්වයක් පවත්වා ගැනීම මගින් NaHCO3 ස්ඵටිකීකරණය වීම ප්රවර්ධනයකරයි.
- අටලු 2 දිම ප්රතික්රියක ප්රතිවිරුද්ධ දිශා වලට එවීම මගින් මිශ්ර වීම කාර්යක්ෂම කිරීම ප්රතිප්රවාහ මුලධර්මය මගින් සිදු වේ.
- Na2CO3 පිළියල කර ගැනීම පිණස සැදෙන NaHCO3 තාප වියෝජනය කරන විට පිටවන CO2 වායුව පිරිසුදු කර දෙවන අටලුවේ පහළින් එකතු කිරීම මගින් ක්රියාවලියේ නිශ්පාදන පිරිවැය අඩු කර ගත හැක.
- දෙවන අටලුවේ පහළින් එකතු කිරීම සදහා CO2 පිළියෙල කර ගැනීමට ලබා ගන්නා හුනුගල් තාප වියෝජනයෙන් පසු ඉතිරි වන අලුහුනු ක්රියාවලියේ අතුරු ඵලය වන NH4Cl සමග එකතු කරවීම NH3 වායුව පුනර්ජනනය කොට නිශ්පාදන පිරිවැය අඩු කිරිමට හේතු වේ.
CaCO3 (s) →∆ CaO (s) + CO2 (g)
CaO(s) +2 NH4Cl (aq) → CaCl2 (aq) +2NH3 (g) +H2O (l)
- ක්රියාවලි ප්රශස්තීකරණ උපාය මාර්ග ද සැලකු විට සෝල්වේ ක්රමයේ සමස්ත ප්රතික්රියාව පහත පරිදි ලියා දැක්විය හැක.
2NaCl (aq) +CaCO3 (s) → CaCl2 (aq) + Na2CO3(s)
- නමුත් ඝන CaCO3 හා ජලීය NaCl මිශ්ර කිරීමෙන් ප්රා යෝගිකව Na2CO3 නිපදවා ගත හැක.
- KHCO3 හි ජල ද්රාව්යතාවය NaHCO3 හි ජල ද්රාව්යතාවයට වඩා වැඩි බැවින් අටලු තුලදී අවක්ශේප නොවේ.ඒ නිසා KHCO3සාදා ගැනීමට ඉහත ක්රමය යොදා ගත නොහැක.
Na2CO3/NaHCO3 හි ප්රයෝජන
1.Na2CO3
- කඩදාසි නිපදවීමේ දී දැව පල්පයට මිශ්ර කිරීමට.
- වීදුරු නිපදවීමට.
- දෙවුම් සෝඩා ලෙස යොදා ගැනීම.
- ජලය මෘදුකරණය සදහා භාවිතය. ( ජලයේ කඨිනත්වය ඉවත් කිරිම )
- සබන් හා ක්ෂාලක නිපදවීමේ දී ශෝධන ක්රියාව වර්ධනය කිරිමට.
2.NaHCO3
- බේකින් පවුඩර් නිපදවීමට.
- ආහාර නිපදවිමට භාවිතය.
- බෙහෙත් නිපදවීමට.
සෝල්වේ ක්රමය ආර්ථික වශයෙන් වාසිදායක වීමට හේතු
- NaCl හා CaCO3 අඩු වියදමකින් පහසුවෙන් ලබා ගක හැකි වීම.
- NH3 වැය නොවන අතර චක්රිකරණය මගින් නැවත නැවතත් භාවිතා කළ හැකි වීම.
- CO2 වලින් කොටසක් නැවත භාවිතා කළ හැකි වීම.
සෝල්වේ ක්රමය ආශ්රිත පාරිසරික ගැටලු
- Na2CO3 පස හා ජලය භාශ්මීකරණය සිදු කරයි.
- NH3 පස හා ජලය භාශ්මීකරණය සිදු කරයි.
- NaCl පස හා ජලය ලවනීකරණය සිදු කරයි.
- CaCO3 ස්වභාවික සම්පත් හායනය සිදු කරයි.
- CO2 ගෝලීය උනුසුම්කරණය සිදු කරයි.
සබන් නිශ්පාදනය
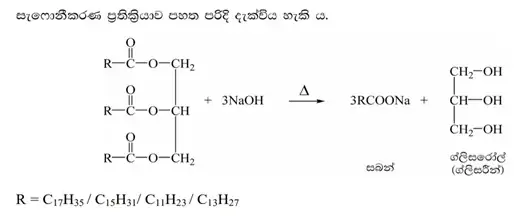
- අමුද්රව්ය -: ශාක හෝ සත්ව තෙල්, NaOH හෝ KOH
- සබන් නිෂ්පාදනයේ දී සිදුවන්නේ ට්රයිග්ලිසරයිඩ, කෝස්ටික් සෝඩා සමඟ රසායනිකව ප්රතික්රියාවක් වී, ජලවිච්ඡේදනය වී ග්ලිසරෝල් හා දිගු දාම සහිත කාබොක්සිලික් අම්ලවල සෝඩියම් ලවණ සෑදීමයි.
- මෙම ලවන සබන් ලෙස හඳුන්වයි. සබන් ද්රාවණයක C හා H අඩංගු ජලභීතික වලිගයක් හා Na+ හෝ K+ හා -COO- අයන කාණ්ඩයක් අඩංගු ජලකාමී හිසක් ඇත.
- සබන් නිෂ්පාදනයට බහුලව පොල්තෙල් යොදා ගනී.
- පොල්තෙලහි ට්රයිග්ලිසරයිඩ වලට එස්ටර බන්ධන වලින් බැඳී ඇත්තේ ලෝරික් අම්ලය, මිරිස්ටික් අම්ලය, ඔලෙයික් අම්ලය හා ස්ටියරික් අම්ලය යන මේද අම්ල වේ.
- මීට අමතරව මේද අම්ල සුළු ප්රමාණයක් එස්ටර බන්ධන සාදන්නේ නැතිව නිදහස් මේද අම්ල ලෙස පවතී .
- පොල් තෙල් භාවිතා කර නිපදවන සබන් ද මෙම මේද අම්ලවල සෝඩියම් ලවණ මිශ්රණයකි.
- සබන් අණුවක ඇති කාබන් පරමාණු සංඛ්යාව 12, 14, 16, 18 ලෙස වෙනස් වේ.
- පොල්තෙල් වල ඇති මේද අම්ලවල විස්තරයක් පහත දැක්වේ
- ලෝරික් අම්ලය – පොල්තෙල් වල 44% – 52% ක් පමණ ඇත. එහි කාබන් පරමාණු 12කි. එයින් 11 ක්ම ජලභීතික වලිගය ආශ්රිතව ඇත.
- මිරිස්ටික් අම්ලය – පොල්තෙල් වල 14% පමණ ඇත .කාබන් පරමාණු 14කි.
- පාමිටික් අම්ලය– පොල්තෙල් වල 8% පමණ ඇත . කාබන් පරමාණු 16කි.
- ස්ටියරික් අම්ලය – පොල්තෙල්වල 3% පමණ ඇත . කාබන් පරමාණු 18ක් ඇත .
- ඔලෙයික් අම්ලය– පොල්තෙල් වල 5% – 8% පමණ ඇත . කාබන් පරමාණු 18ක් හා ද්විත්ව බන්ධනයක් ඇත .
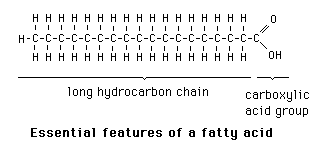
මේද අම්ලයක රසායනික ව්යුහය
- සබන් නිපදවිය හැකි ක්රියාවලි දෙකකි .
- ශීත ක්රියාවලිය – මෙහිදී ග්ලිසරෝල් හා සබන් වෙන් නොකරයි .ග්ලිසරෝල් සබන් තුළ තැන්පත් වේ .
- උණුසුම් ක්රියාවලිය
උණුසුම් ක්රියාවලිය
- තෙල්වල වර්ණක හා අපද්රව්ය ඉවත් කිරීමට සක්රීය ෆුලර් අ(ර්)ත් (active fuller earth ) ලෙස හඳුන්වන විශේෂ මැටි වර්ගයක් මතින් යවනු ලැබේ .
- එහි උෂ්ණත්වය 90 0C පමණ පවත්වා ගනී .ඉන්පසු මැටි අංශු ඉවත් කර සබන් නිෂ්පාදනයට යොදා ගනී
- ඉන් පසු සබන් නිෂ්පාදනය පියවර 4ක් ඔස්සේ සිදු කරයි.
- සැෆොනීකරණය
- අතුරු ඵලය වූ ග්ලිසරින් ඉවත් කිරීම
- සබන් පිරිපහදු කිරීම
- නිමි සබන් බවට පත් කිරීම
1. සැෆොනීකරනය
- මෙහිදී පිරිපහදු කළ ශාක තෙල් , ජලීය NaOH හෝ KOH සමග කුටීරයට පොම්ප කරනු ලැබේ .
- NaOH ජලයේ දියවීම තාප තාපදායක බැවින් එය වෙනම ක්රියාවලියක් ලෙස සිදු කරයි .
- තෙල් හා NaOH එකිනෙක මිශ්ර නොවන බැවින් ස්ථර දෙකෙහි අතුරු මුහුණතේ දී සැෆොනිකරණ ප්රතික්රියාවෙන් ග්ලිසරින් හා සබන් සෑදේ .
- මෙහිදී NaOH උදාසීනකරණය වන බැවින් තාපය නිපදවේ.
- නමුත් මිශ්රණයේ උෂ්ණත්වය 70 OC හි පවත්වාගෙන මිශ්රණය හොඳින් මිශ්ර කරයි .
- එවිට තෙල් බිඳිති බවට පත්වී පෘෂ්ඨික වර්ගඵලය වැඩි වන බැවින් ප්රතික්රියාවේ කාර්යක්ශමතාව වැඩිවේ.
2. ග්ලිසරින් ඉවත් කිරීම .
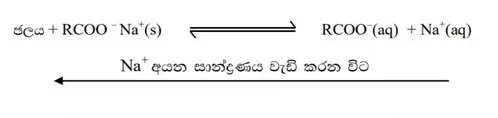
- සැෆොනීකරණයෙන් පසුව ලැබෙන ජලීය කලාපයෙහි භාෂ්මිකතාව අඩුවී ඇත.
- මෙම ජලීය කලාපයේ ග්ලිසරින්ද සබන් යම් ප්රමාණයක් ද දිය වී ඇත .
- සබන් අයනීකරණය වී ඇති බැවින් පහත ලෙස සමතුලිතතාවයක් පවත්වා ගනී .
- ජලීය කලාපයේ සබන් ද්රාව්යතාව අඩු කිරීමට NaCl ( බ්රයින් ) එක් කරයි .
- Na+ සාන්ද්රණය ඉහළ යන බැවින් පහත සමතුලිතතාව වම් පසට නැඹුරු වී සබන් අණු ජල කලාපයෙන් වෙන් වේ.
- NaCl කිරීම නිසා ජල කලාපයේ ඝනත්වය වැඩි වේ.
- මෙවිට ජලීය කලාපයෙන් වෙන්වන අශුද්ධ සබන් ජලය මත පාවේ .
- ග්ලිසරින් සහිත ජලීය කලාපය පොම්ප කර ඉවත් කිරීමෙන් සබන් වෙන්කර ගනී .
- ග්ලිසරින් ලබාගැනීමට මෙම ලවණ සහිත ජලීය කලාපය හොඳ ප්රභවයකි .
- ග්ලිසරින් ඉවත් කළ පසු නැවත එම ලවණ ද්රාවණයට අවශ්ය තරම් NaCl එකතු කෙරේ .
- අශුද්ධ සබන් තුළ ඇති ග්ලිසරින් ඉවත් කිරීමට එම ද්රාවණය භාවිතා කරයි .(ග්ලිසරින් ලවණ ද්රාවණයයේ දිය වුවත් සබන් දිය නොවන බැවින් )
- මෙහිදී සබන් එම ලවණ ද්රාවණය හා හොඳින් මිශ්ර කෙරේ.
- අනතුරුව ග්ලිසරින් සහිත ලවණ ද්රාවණය හා යම්තාක් දුරකට පිරිපහදු වූ සබන් ද්රාවණය වෙන්කර ගනී .
3. සබන් පිරිපහදු කිරීම .
- ග්ලිසරින් ඉවත් කළ සබන් තුල ජලය සහ NaCl ලවණ ඇත.
- එම NaCl හා සබන් වෙන්වන තුරු සබන් කේන්ද්රාපසරණය කරයි .
- එවිට සබන් වල NaCl සංයුතිය 0.5%(w/w) දක්වා අඩුවේ.
- සබන්වල වල NaOH තිබීම හමේ, ඇසේ පටක වලට හානි සිදු කරයි .
- එබැවින් සුළු වශයෙන් හෝ ඇති NaOH උදසීන කිරීමට සිට්රික් අම්ලය , පොස්පරික් අම්ලය හෝ පොල් තෙල් ආශ්රිත නිදහස් මේද අම්ල එක් කරයි .
4. නිමි සබන් බවට පත් කිරීම .
- අවසන් වශයෙන් සබන් තුළ ඇති ජල ප්රමාණය 12% (w/w) තෙක් අඩු කළ යුතුය .
- මේ සඳහා 120 OC ට රත්කළ සබන් අඩු පීඩන කලාපයකට සියුම් බිඳිති ලෙස විසුරුවනු ලැබේ .
- එවිට ජලය වාෂ්ප වීමට තාපය ලබා ගන්නා බැවින් සබන් සිසිල් වී තැන්පත් වේ.
- ජල වාෂ්ප ඉවත් කර වියලි සබන් වලට පිරවුම් කාරක ,වර්ණක, සුවඳකාරක මිශ්රකර, හැඩ ගන්වා නිමි සබන් නිපදවනු ලැබේ.
සබන්වල TFM (total fatty matter ) අගය
- සබන් වල ඇති මුළු මේදමය ද්රව්ය (එනම් RCOONa) ප්රතිශතය මෙමගින් දක්වයි.
- රෙදි සෝදන සබන් වල TFM අගය 54%- 56% වන අතර ඉතිරිය පිරවුම් ද්රව්ය වර්ණක ශෝධනය වර්ධනය කරන ද්රව්ය වේ .
- කඨින ජලයේදී සබන් ජලයේ ඇති කැටායන හා ප්රතික්රියා කර අවක්ශේප වන බැවින් සබන් එම ජලයේ දිය නොවන අතර පෙන නොනගී.
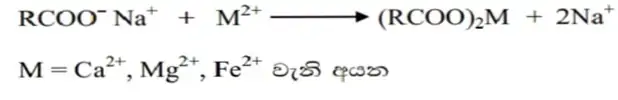
- ක්ශාලක කඨින ජලයේ දී අවක්ශේප නොවේ. කෘතිම ක්ෂාලක තුළ ඇති ප්රධානම සංඝටකය ඇල්කයිල්බෙන්සිල්සල්ෆොනේට් වේ.
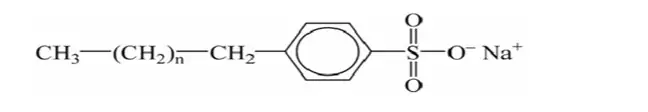
ඇල්කයිල්බෙන්සිල්සල්ෆොනේට් අණුවේ ව්යුහය
සබන්වල ශෝධන ක්රියාව

- කුණු යනු තෙල් පටලයක් වටා එකතු වූ වූ දූවිලි අංශු හා කාබනික සංයෝග මිශ්රණයකි.
- ජලයේ පෘෂ්ඨික ආතතිය වැඩි ය . එබැවින් ජලය පමණක් යෙදූ විට කුණු ඉවත් නොවේ .
- සබන් මගින් ජලයේ පෘෂ්ඨික ආතතිය අඩුකර ශෝධන ක්රියාව වර්ධනය කරයි .
- සබන් අනු තෙල් බිඳිති සමග ඉහත ආකාරයට මිසෙල්ලා සාදන බැවින් කුණු ඉවත් වේ.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

