භෞතික ලක්ෂණ
1. d ගොනුවේ සියල්ල ලෝහ වේ.
- d ගොනුවේ ලෝහ වල අවසන් කවචයේ ns ඉලෙක්ට්රෝන පමණක් නොව ඊට ඇතුළු කවචයේ සමහර වියුග්ම (n-1)d ඉලෙක්ට්රෝන ද ලෝහක බන්ධනය සඳහා සහභාගි වේ.
- ඉහත කී ඉලෙක්ට්රෝන ඉවත් වීමෙන් සෑදුණු ධන අයන දැලිසක් හා නිදහස් ඉලෙක්ට්රෝන ජලාශයක් ලෙස ඇති අතර මෙම නිදහස් ඉලෙක්ට්රෝන එක් අයනයකටවත් ස්ථාවරව නොබැඳී අවට ඇති සියලුම ධන අයන ආකර්ෂණය කරගෙන සිටී.
- එම නිසා ධන අයන විසිරී නොගොස් එකට බැඳී ඇත. මෙසේ ඇති වන බැඳීම ලෝහක බන්ධන ලෙස හඳුන්වයි.

2. මේවා හොඳ විද්යුත් හා තාප සන්නායක වේ.
- මෙහිදී බාහිර s ඉලෙක්ට්රෝන පමණක් නොව ඇතැම් d ඉලෙක්ට්රෝන ද ඉලෙක්ට්රෝන ජලාශය සෑදීමට සහභාගී වන නිසා ඉලෙක්ට්රෝන වලාවේ ඝනත්වය වැඩි වේ. එබැවින් වැඩි ඉලෙක්ට්රෝන ප්රමාණයක් නිදහසේ චලනය දැක්වීම නිසා විද්යුත් සන්නායකතාව ඉහළ වේ.
- තාපය ලබා ගත් විට අංශුවල කම්පනය වැඩිවේ. එවිට ධන අයන හා ඉලෙක්ට්රෝන අංශු අතර ගැටුම් සිදුවීමේදී ශක්තිය හුවමාරු වීම නිසා ලෝහය තාපය සන්නයනය කරයි. d ගොනුවේ ලෝහ හොඳ විද්යුත් හා තාප සන්නායක වෙයි.
3. දෘඪතාවය ඉහළ ය.
- Hg හැර අන් සියල්ල ඝන අවස්ථාවේ වන අතර දෘඩතාව ඉහළ වීමට හේතුව වඩා ශක්තිමත් ලෝහක බන්ධන පැවතීමයි. වියුග්ම ඉලෙක්ට්රෝන සහිත පරමාණුක කාක්ෂික වැඩිවන විට පරමාණු අතර ක්රියාත්මක වන අතිච්ඡාදන වැඩි වේ. තව ද පරමාණුවේ අරය කුඩා වන විට ද ලෝහක බන්ධන ශක්තිමත් බවින් වැඩිවීම සිදුවෙයි. එවිට දෘඪතාව වැඩි වේ.
- වැඩිම වියුග්ම ඉලෙක්ට්රෝන ගණනක් ඇති Cr හා Mo වල දෘඪතාව ඉතා ඉහළ ය.
- වියුග්ම ඉලෙක්ට්රෝන නොමැති Zn, Cd එතරම් දෘඪ නොවෙයි.
- වියුග්ම ඉලෙක්ට්රෝන නොමැති පරමාණුක අරය සාපේක්ෂව විශාල Hg වල ලෝහක බන්ධනය දුබල නිසා එය ද්රව තත්වයේ ඇත.
4. ද්රවාංක තාපාංක ඉහළ අගයන් වේ.
- ශක්තිමත් ලෝහක බන්ධන නිසා ද්රවාංක තාපාංක ඉහළ වේ. වියුග්ම e සංඛ්යාව වැඩිවීමත් සමඟ ලෝහක බන්ධන ප්රබලතා වැඩි වෙයි.
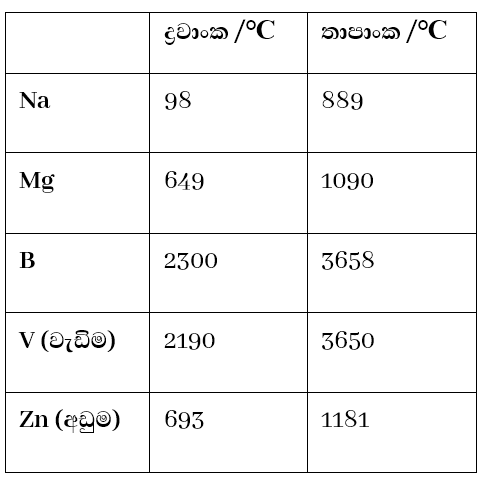
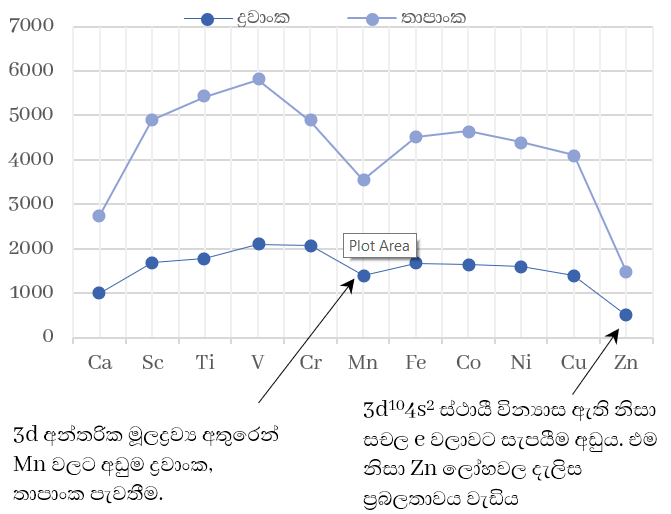
3d අන්තරික මූලද්රව්ය අතුරෙන් Mn වලට අඩුම ද්රවාංක, තාපාංක පැවතීමට හේතුව,
Mn වල අර්ධව පිරුණු 3d5 උපශක්තිමට්ටම හා සම්පූර්ණයෙන් පිරුණු 4s2 උපශක්තිමට්ටම සමඟ 3d5 4s2 වින්යාසයට ඉලෙක්ට්රෝන විස්ථානගත කිරීමේ හැකියාව අඩු නිසා සචලතා ඉලෙක්ට්රෝන වලාවට ඉලෙක්ට්රෝන සහභාගි කරවීම අපහසු වේ.
5. ඝනත්ව අගයන් ඉහළ ය.
- එකම ආවර්තයේ මූලද්රව්ය සැලකූ විට s හා p ගොනුවලට වඩා d ගොනුවේ මූලද්රව්ය වල අරය, පරිමාව අඩුය. එබැවින් දැලිස තුළ පරමාණු වඩා එකිනෙකට ලංව ඇසිරී පැවතීම නිසා ඒකීය පරිමාවක ස්කන්ධය හෙවත් ඝනත්වය ඉහළ වේ.
- ඝනත්වය අඩුම : Sc (3.01 g cm-3)
- ඝනත්වය වැඩි ම : Cu (8.93 g cm-3)
රසායනික ලක්ෂණ
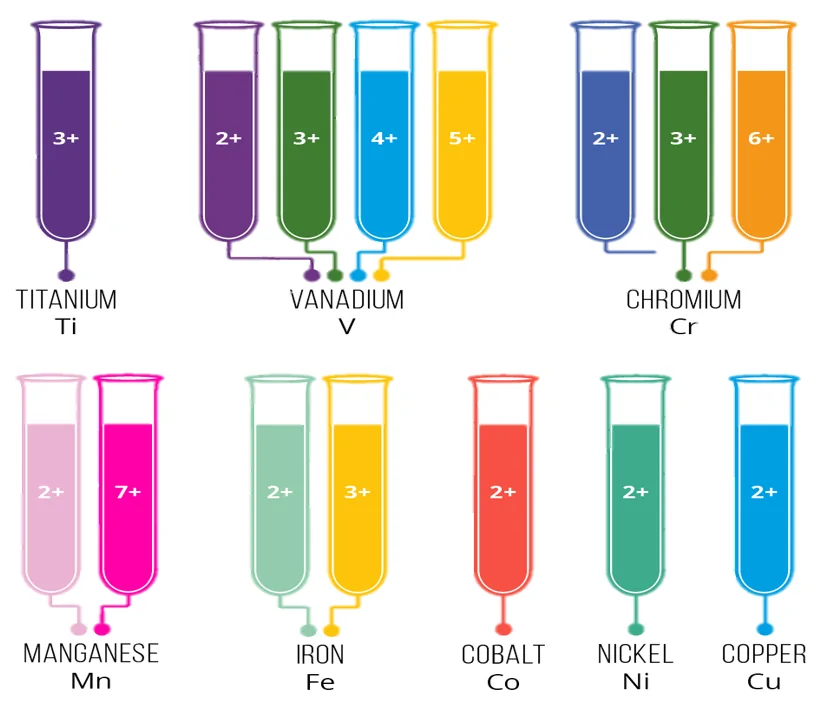
1. විචල්ය ඔක්සිකරණ අංක දක්වයි.
- උදා : Aluminum සලකමු.

I4 සාපේක්ෂව ඉතා විශාල නිසා අයන සෑදීමේ දී ඉවත් වන උපරිම ඉලෙක්ට්රෝන ගණන තුනකි. එනම් ස්ථායි වින්යාසයට පිටතින් ඇති 3s23p1 ඉලෙක්ට්රෝන තුන ඉවත්කර ඉවත් කර 3+ සාදයි.
- Vanadium සළකමු.
 අයනීකරණ එන්තැල්පි I1 සිට I5 දක්වා කැපී පෙනෙන ශීඝ්ර වැඩි වීමක් නැත. එම නිසා +2, +3, +4, +5 ලෙස ඔක්සිකරණ අංක පවතී.
අයනීකරණ එන්තැල්පි I1 සිට I5 දක්වා කැපී පෙනෙන ශීඝ්ර වැඩි වීමක් නැත. එම නිසා +2, +3, +4, +5 ලෙස ඔක්සිකරණ අංක පවතී.
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| 3d14s1 | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 | 3d104s2 |
| +3 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +1 | +2 |
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +2 | ||
| +4 | +4 | +6 | +4 | ||||||
| +5 | +6 | ||||||||
| +7 |
2. d ගොනුවේ විද්යුත් ඍණතාව වැඩිය.
- d ගොනුවෙහි මූලද්රව්ය වලට වඩා ධන අයන සෑදීමේ පහසුව s ගොනුවේ මූලද්රව්ය වල සාමාන්යයෙන් වැඩිය. එම නිසා d ගොනුවට වඩා s ගොනුවේ මූලද්රව්යවල විද්යුත් ධනතාව වැඩිය . එනිසා d ගොනුවේ විද්යුත් ඍණතාව සාපේක්ෂෂවවැඩි බව තර්ක කල හැකිය.
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| 1.3 | 1.5 | 1.6 | 1.6 | 1.5 | 1.8 | 1.8 | 1.8 | 1.9 | 1.6 |
- කිසියම් පරමාණුවක් විචල්ය ඔක්සිකරණ අංක පෙන්වයි නම් එහි ඉහළම ඔක්සිකරණ අංකයට ඉහළ විද්යුත් ඍණතාවක් ඇත.
3. d ගොනුවේ ඇතැම් මූලද්රව්යවල, අයන වලට ලිගන්ඩ සමග සංගත සංකීර්ණ සෑදීමේ හැකියාව ඇත.
- ඊට හේතු වන්නේ,
- අරය කුඩාවීම
- ආරෝපණය විශාල වීම.
- අඩු ශක්ති සහිත හිස් d කාක්ෂික පැවතීම.
- ආන්තරික මූලද්රව්යවල සංගත බන්ධන සෑදීම සඳහා උපයෝගී කරගන්නේ (n-1)d, ns np හා (n+1)d උප ශක්ති මට්ටම් වලට අයත් හිස් කාක්ෂිකය. (n = 3, 4, 5)
| මධ්ය පරමාණුව වටා ලිගන්ඩ ගණන | හැඩය | උදාහරණ |
|---|---|---|
| 2 | රේඛීය | [Ag(NH3)2]+, [Cu(NH3)2]+ |
| 4 | චතුස්තලීය | [CoCl4]2-, [CuCl4]2-වැනි X¯ අයන 4 ක් අඩංගු සංකීර්ණ |
| 4 | තලීය සමචතුරස්ර | [Cu(NH3)4]2+,[Ni(CN)4]2- |
| 6 | අෂ්ටතලීය | M2+, M3+ අයන වලට H2O, NH3 වැනි ඒවා 6 ක් බැඳුණූ සංගත සංකීර්ණ |

4. d ගොනුවේ මූලද්රව්යවලට, අයනවලට, සංයෝගවලට බොහෝවිට උත්ප්රේරක ලක්ෂණ පවතී.
- අර්ධ වශයෙන් පිරුණු හෝ හිස් කාක්ෂික පැවතීම හේතුවෙන් බොහෝ ආන්තරික ලෝහ සහ සංයෝග උත්ප්රේරක වශයෙන් හැසිරේ.
- උදා :
- හයිඩ්රජනීකරණය සඳහා – Pd
- ඇමෝනියා නයිට්රජන් ඔක්සයිඩ් බවට ඔක්සිකරණයට – Pt/Rh
- SO2, SO3 බවට ඔක්සිකරණය – V2O5
- එතීන් බහු අවයවීකරණය සඳහා – TiCl3/Al(C2H5)6
- සෑන්ඩ්මයර් ප්රතික්රියාවට – Cu
5. ඔක්සිකාරක ඔක්සිහාරක ගුණ
Fe2+ → Fe3+
Cu2+ → Cu+
6. ආන්තරික මූලද්රව්ය වර්ණවත් ලෝහ කැටායන සාදයි.
- ජලීය ද්රාවණවල ඇති බොහෝ ආන්තරික මූලද්රව්ය අයන විද්යුත් චුම්භක වර්ණාවලියේ දෘශ්ය කලාපයට අයත් විකිරණ අවශෝෂණය කර විවිධ වර්ණ නිපදවයි. මේ හැකියාව ඇති වන්නේ අර්ධ ලෙස පිරුණු d උප කාක්ෂික පිහිටීම නිසාය.
- අර්ධ වශයෙන් පිරුණු d උප කාක්ෂික නොපිහිටීම නිසා ජලීය Sc3+ හා Zn2+ අවර්ණ වේ.
- තවද ජලීය ද්රාවණවල දී d0 හා d10 වින්යාසය ඇති කැටායන අවර්ණ වේ.
- ජලීය ද්රාවණවලදී වර්ණ පහත පරිදි වේ.
| අයනය | වර්ණය | අයනය | වර්ණය | ||
| Sc3+ | (d0s0) | අවර්ණ | Ni2+ | (d8s0) | කොළ |
| Ti4+ | (d0s0) | අවර්ණ | Cu2+ | (d9s0) | නිල් |
| Cr3+ | (d3s0) | දම් | Cu+ | (d10s0) | අවර්ණ |
| Mn2+ | (d5s0) | ලා රෝස | Zn2+ | (d10s0) | අවර්ණ |
| Fe3+ | (d5s0) | දුඹුරු කහ | Ti3+ | (d1s0) | දම් |
| Fe2+ | (d6s0) | ලා කොල | Cr2+ | (d4s0) | නිල් |
| Co2+ | (d7s0) | රෝස | Mn3+ | (d4s0) | දම් |
ඔක්සයිඩවල ස්වභාවය
- d ගොනුවේ මූලද්රව්යවල කිසියම් ලෝහයකට ඔක්සිකරණ අංක රාශියක් ඇතිවිට ඔක්සයිඩවල ගුණ ඔක්සිකරණ අංකය මත රඳාපවතී. බන්ධන ස්වභාවය ඔක්සිකරණ අංකය මත රඳාපවතී. බන්ධන ස්වභාවයේ වෙනස්වීම මගින් ලෝහ ඔක්සයිඩවල අම්ල භෂ්ම ස්වභාවය තීරණය කරයි. ඉහළ ඔක්සිකරණ අංක ඇති සංයෝගවල සහසංයුජ බන්ධන නිසා ආම්ලික වන අතර පහළ ඔක්සිකරණ අංක ඇති සංයෝගවල අයනික ලක්ෂණ නිසා භාෂ්මික වේ.
| VO | (+2) | භාෂ්මික |
| V2O3 | (+3) | භාෂ්මික |
| VO2 | (+4) | උභයගුණි |
| V2O5 | (+5) | ආම්ලික |
| CrO | (+2) | දුබල භාෂ්මික |
| Cr2O3 | (+3) | උභයගුණි |
| CrO2 | (+4) | දුබල ආම්ලික |
| CrO3 | (+6) | ආම්ලික |
| MnO | (+2) | භාෂ්මික |
| Mn2O3 | (+3) | දුබල භාෂ්මික |
| MnO2 | (+4) | උභයගුණි |
| MnO3 | (+6) | දුබල ආම්ලික |
| Mn2O7 | (+7) | ආම්ලික |

