- රසායනික සංයෝගයක පරමාණුවක් විසින් ප්රදානය කරන නැතහොත් ප්රතිග්රහනය කෙරෙන ඉලෙක්ට්රෝන සංඛ්යාව විස්තර කෙරෙනුයේ ඔක්සිකරණ අංකයෙනි.
- ඔක්සිකරණ අංකය යනු, සහසංයුජ සංරචකයකින් තොරව සියලු බන්ධන අයනික සේ සලකන ලද්දේ නම් යම් පරමාණුවකට අත්වන ආරෝපණය සේ සැලකිය හැකිය.
- උදාසීන මූලද්රව්යයකදී එම මූලද්රව්යයට හිමි ඔක්සිකරණ අංකය ශූන්ය ලෙසට සලකනු ලබයි.
- පරමාණුවක පාලනයෙන් ඉලෙක්ට්රෝන ගිලිහී යාම ධන ඔක්සිකරණ අංක ඇති වීමටත්, පරමාණුවක පාලනයට අලුතින් ඉලෙක්ට්රෝන යටත් වීම ඍණ ඔක්සිකරණ අංක ඇතිවීමටත් හේතු වේ.
පරමාණු / අයන විසින් ප්රදර්ශනය කරන විවිධාකාර ඔක්සිකරණ අංක සදහා නිදසුන්
|
වර්ගය |
ඔක්සිකරණ අංකය |
නිදසුන් |
|
මූලද්රව්ය තත්ත්වයේ පරමාණු |
ශුන්යය. |
Na(s) , He(g) , Hg(g), N2(g) , |
|
ඒක පරමාණුක අයන |
ආරෝපණයට සමාන වේ. |
Na+ , O2- , Ca2+ |
|
ෆ්ලූවොරීන් |
සැම විටම -1 |
NaF , OF2 |
|
ඔක්සිජන් |
-2 +2 -1 -1 හා ශුන්ය |
H2O , P2O5 , OF2 පමණි. පෙරොක්සයිඩ / O22- සුපරොක්සයිඩ / O2– |
|
හයිඩ්රජන් |
+1 -1 |
H2O , CH4 ලෝහ හයිඩ්රයිඩ පමණි |
අණුවක / බහුපරමාණුක අයනයක හෝ සංයෝගයක ඇති පරමාණුවක ඔක්සිකරණ අංකය නිර්ණය කිරීමේදී භාවිතාවන මූලික නීති
මූලික නීති 02කි.
- සංයෝගයක සියලු පරමාණු වල ඔක්සිකරණ අංකවල එකතුව ශූන්ය වේ.
- අයනයක ඇතුලත් සියලු පරමාණුවල ඔක්සිකරණ අංකවල එකතුව එහි ආරෝපණයට සමාන වේ.
ඔක්සිකරණ අංකය වීජීය ක්රමයෙන් සෙවීම
(1) අණුවල අඩංගු පරමාණුවක ඔක්සිකරණ අංකය නිර්ණය කිරීම
- උදාහරණ 01 : HClO3 හි Cl වල ඔක්සිකරණ අංකය නිර්ණය කරමු.
- HClO3 හි සමස්ථ ආරෝපණය ශූන්ය වේ.
\begin{array}{rcl}\lbrack\text{ H හි ඔක්සිකරණ අංකය}\;\rbrack\;+\;3\lbrack\;\text{O හි ඔක්සිකරණ අංකය}\;\rbrack\;+\;\lbrack\text{ Cl හි ඔක්සිකරණ අංකය}\;\rbrack\;&=&\;0\\\;\lbrack+1\;\rbrack\;+\;3\;\lbrack\;-2\;\rbrack\;+\;\lbrack\;\text{Cl හි ඔක්සිකරණ අංකය}\;\rbrack\;&=&\;0\\\;\text{Cl හි ඔක්සිකරණ අංකය}\;&=&\;5\end{array}
- උදාහරණ 02 : NH3 හි N වල ඔක්සිකරණ අංකය නිර්ණය කරමු.
- NH3 හි සමස්ථ ආරෝපණය ශූන්ය වේ.
\begin{array}{rcl}3\;\lbrack\;\text{H හි ඔක්සිකරණ අංකය}\;\rbrack\;+\;\lbrack\text{ N හි ඔක්සිකරණ අංකය}\;\rbrack\;&=&\;0\;\\3\;\lbrack+1\rbrack\;+\;\lbrack\;\text{N හි ඔක්සිකරණ අංකය}\;\rbrack\;&=&\;0\;\\\text{N හි ඔක්සිකරණ අංකය}\;&=&\;-3\end{array}
(2) බහුපරමාණුක අයණ වල අඩංගු පරමාණුවක ඔක්සිකරණ අංකය නිර්ණය කිරීම.
- උදාහරණ 01 : Cr2O7 2- අයණයේ Cr වල ඔක්සිකරණ අංකය නිර්ණය කරමු.
- Cr2O7 2- හි සමස්ථ ආරෝපණය -2 වේ.
\begin{array}{rcl}7\;\lbrack\;\mathrm{Oහි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;+\;2\;\lbrack\;\mathrm{Cr}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;&=&\;-2\\\;7\;\lbrack\;-2\;\rbrack\;+\;2\;\lbrack\;\mathrm{Cr}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;&=&\;-2\;\\\mathrm{Cr}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;&=&\;+6\end{array}
- උදාහරණ 02 : NO3- හි N වල ඔක්සිකරණ අංකය නිර්ණය කරමු.
- NO3- හි සමස්ථ ආරෝපණය -1 වේ.
\begin{array}{rcl}7\;3\lbrack\;\mathrm O\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;+\;\lbrack\;\mathrm N\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;&=&\;-1\\\;3\lbrack\;-2\;\rbrack\;+\;\lbrack\;\mathrm N\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;&=&\;-1\;\\\mathrm N\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;&=&\;+5\end{array}
(3) සංයෝග වල අඩංගු පරමාණුවක ඔක්සිකරණ අංකය නිර්ණය කිරීම.
- උදාහරණ 01 : CaO හි Ca වල ඔක්සිකරණ අංකය නිර්ණය කරමු.
- CaO හි සමස්ථ ආරෝපණය ශූන්ය වේ.
\begin{array}{rcl}\lbrack\;\mathrm{Ca}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;+\;\lbrack\;\mathrm O\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;&=&\;0\\\;\lbrack\;\mathrm{Ca}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;\rbrack\;+\;\lbrack\;-2\;\rbrack\;&=&\;0\\\;\mathrm{Ca}\;\mathrm{හි}\;\mathrm{ඔක්සිකරණ}\;\mathrm{අංකය}\;&=&\;+2\end{array}
ඔක්සිකරණ අංකය ව්යූහ සූත්ර ක්රමයෙන් සෙවීම
- මෙය ප්රධාන වශයෙන් සහසංයුජ බන්ධන වලින් බැදුණු පරමාණුවල ඔක්සිකරණ අංක නිර්ණය සදහා භාවිතා වේ.
- මෙම ක්රමයේදී අදාළ රසායනික ප්රභේදය සදහා ව්යූහ රූප සටහන ඇඳ එක් එක් බන්ධනය සාදන පරමාණු 2හි විද්යුත් ඍණතා වෙනස මත පදනම්ව ධ්රැවීයතා සලකුණු ලකුණු කොට ලැබෙන සමස්ථ ධ්රැවීයතාවය ඔක්සිකරණ අංකය වශයෙන් ඉදිරිපත් කරයි.
- වඩාත්ම විද්යුත් ඍණ පරමාණුව ඉලෙක්ට්රෝන ප්රතිග්රහනය කරන අතර එය ( – ) ආරෝපණයකින් සලකුණු කෙරේ
- අඩු විද්යුත් ඍණතාවයෙන් යුත් පරමාණුව ඉලෙක්ට්රෝනයක් බැහැර කරන අතර එය ( + ) ආරෝපණයකින් සලකුණු කෙරේ.
- HNO3 හි N පරමාණුවේ ඔක්සිකරණ අංකය නිර්ණය කරමු.
පියවර 1 : සංයෝගයේ බන්ධන ව්යූහය අදින්න.
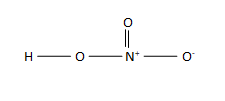
පියවර 2 : විද්යුත් ඍණතා වෙනස පදනම් කර ගනිමින් බන්ධනය වී ඇති පරමාණුවලට +1 හා -1 පවරන්න.
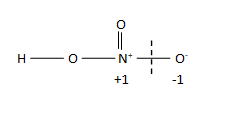
පියවර 3 : ඉලක්ක මූලද්රව්යය වටා ඇති සියලු බන්ධන සදහා පියවර 2 ක්රියාත්මක කරන්න.
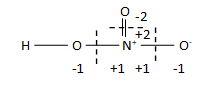
පියවර 4 : ඉලක්ක මූලද්රව්යය වටා ඇති සියලු පවරන ලද අගය එකතු කරන්න.
N = (+2) + (+1) + (+1) + (+1) = +5
- එනම් මධ්ය N පරමාණුවේ ඔක්සිකරණ අංකය +5 වේ.
- උදාහරණ කීපයක් සලකා බලමු.
- CO3 2- හි C පරමාණුවේ ඔක්සිකරණ අංකය
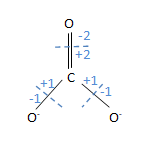
- C පරමාණුවේ ඔක්සිකරණ අංකය = (+2)+(+1)+(+1) = +4
- PCl3 හි P පරමාණුවේ ඔක්සිකරණ අංකය
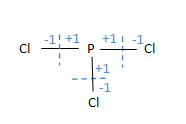
- P පරමාණුවේ ඔක්සිකරණ අංකය = (+1)+(+1)+(+1) = +3
- SOCl2 හි S පරමාණුවේ ඔක්සිකරණ අංකය
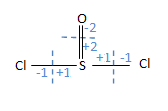
- S පරමාණුවේ ඔක්සිකරණ අංකය = (+2)+(+1)+(+1) = +4
- CH3Cl හි C පරමාණුවේ ඔක්සිකරණ අංකය
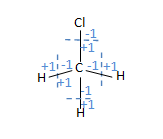
- C පරමාණුවේ ඔක්සිකරණ අංකය = (-1)+(-1)+(-1)+(+1) = -2
රෙඩොක්ස් ප්රතික්රියාවලදී පරමාණු අතර ඉලෙක්ට්රෝන හුවමාරුව පිළිබද අවබෝධයක් ලැබීම සඳහා ඔක්සිකරණ අංක භාවිතය
රෙඩොක්ස් ප්රතික්රියා යනු,
කිසියම් ප්රතික්රියාවකදී එක් පරමාණුවකින් තවත් පරමාණුවකට ඉලෙක්ට්රෝන එකක් හෝ වැඩි ගණනක් මාරු වීමක් සහිතව සිදුවන ප්රතික්රියා ඔක්සිකරණ – ඔක්සිහරණ ප්රතික්රියා හෙවත් රෙඩොක්ස් ප්රතික්රියා නම් වේ.
ඔක්සිකරණය
- පරමාණුවකින් / අයනයකින්, ඉලෙක්ට්රෝනයක් / ඉලෙක්ට්රෝන ඉවත්වීම ඔක්සිකරණය යි.
- ඔක්සිකරණයේදී පරමාණුවක / අයනයක ඔක්සිකරණ අංකය වැඩිවේ.
{\begin{array}{rcl}\underset0{\underset\uparrow{\mathrm M}}&\rightarrow&\underset{}{\underset{+1}{\underset\uparrow{\mathrm M}}^+}+\;\mathrm e\end{array}}
{\begin{array}{rcl}\underset{}{\underset{}{\underset{-2}{\underset\uparrow{\mathrm M}}^{2-}\;}}&\rightarrow&\underset{}{\underset0{\underset\uparrow{\mathrm M}}^{}}+\;2\mathrm e\end{array}}
සටහන: මීට අමතරව සංයෝගයක O පරමාණු සංඛ්යාවේ වැඩිවීමක් හෝ H පරමාණු සංඛ්යාවේ අඩුවීමක් හෝ එම දෙකම හෝ සිදු වේ නම්, එයද ඔක්සිකරණයක් ලෙස හදුනාගත හැක.
ඔක්සිහරණය
- පරමාණුවකින් / අයනයකින්, ඉලෙක්ට්රෝනයක් / ඉලෙක්ට්රෝන ප්රතිග්රහණය කිරීම ඔක්සිහරණයයි.
- ඔක්සිහරණයේදී පරමාණුවක / අයනයක ඔක්සිකරණ අංකය අඩුවේ.
\begin{array}{rcl}\underset0{\underset\uparrow{\mathrm M}}&+\;\mathrm e\rightarrow&\underset{}{\underset{-1}{\underset\uparrow{\mathrm M}}^-}\end{array}
\begin{array}{rcl}\underset{}{\underset{}{\underset{+2}{\underset\uparrow{\mathrm M}}^{2+}+\;\;2\mathrm e}}&\rightarrow&\underset{}{\underset0{\underset\uparrow{\mathrm M}}^{}}\end{array}
සටහන : මීට අමතරව O පරමාණු සංඛ්යාවේ අඩුවීමක් හෝ H පරමාණු සංඛ්යාවේ වැඩිවීමක් හෝ දෙකම හෝ සිදුවේනම්, එය ද ඔක්සිහරණය ලෙස හඳුනාගත හැකිය.
- ප්රතික්රියාවක් සිදුවීමේදී ඔක්සිකරණය සහ ඔක්සිහරණය යන දෙකම එකවර සිදු වේ.
- එම නිසා ප්රතික්රියාවකදී එක් ප්රතික්රියකයක් ඔක්සිකරණය වුවහොත් අනෙක් ප්රතික්රියකය ඔක්සිහරණය විය යුතුයි.
උදාහරණ 01 : C2H6 දහනය
\underset{-3}{\underset\uparrow{\mathrm C\;}}{\mathrm H}_3\;\;\underset{-3}{\underset\uparrow{\mathrm C}}\;\;\;\underset{+1}{\underset\uparrow{{\mathrm H}_{3(\mathrm g)}}}+\frac72\;\underset0{\underset\uparrow{\mathrm O}}\;_{2(\mathrm g)}\rightarrow2\underset{+4}{\underset\uparrow{\mathrm C}}\;\underset{-2}{\underset\uparrow{\mathrm O}}\;_{2(\mathrm g)}\;+3\underset{+1}{\underset\uparrow{\mathrm H}}\;_2\;\underset{-2}{\underset\uparrow{\mathrm O}}(\mathrm g)
- මෙහිදී C හා O වල ඔක්සිකරණ අංක වෙනස් වේ.
- H වල ඔක්සිකරණ අංකය වෙනස් නොවේ.
- C වල සමුච්චිත ඔක්සිකරණ අංකය -6 සිට +8 දක්වා වෙනස් වේ.
- එබැවින් C ඔක්සිකරණය වේ.
- O වල සමුච්චිත ඔක්සිකරණ අංකය 0 සිට -2 දක්වා වෙනස් වේ.
- එබැවින් O ඔක්සිහරණය වේ.
- ඔක්සිකරණ ප්රතික්රියාව : C2H6 හි කාබන් ඔක්සිකරණය වී CO2 නිපදවයි. මෙහිදී ඉලෙක්ට්රොන 14ක් ඉවත් වේ.
- ඔක්සිහරණ ප්රතික්රියාව : ඔක්සිජන් ඔක්සිහරණය වී H2O හා CO2 නිපදවයි. මෙහිදී සමස්ත වශයෙන් ඉලෙක්ට්රොන 4ක් ප්රතිග්රහණයක් සිදුවේ.
උදාහරණ 02 : CH4 දහනය
\underset{-4}{\underset\uparrow{\mathrm C}}\;\;\underset{+1}{\underset\uparrow{\mathrm H}}\;_{4(\mathrm g)\;}+2\underset0{\underset\uparrow{\mathrm O}}\;_{2(\mathrm g)}\;\rightarrow\underset{+4}{\underset\uparrow{\;\mathrm C}}\;\underset{-2}{\underset\uparrow{\mathrm O}}\;_{2(\mathrm g)}\;+2\;\underset{+1}{\underset\uparrow{\mathrm H}}\;_2\underset{}{\;\underset{-2}{\underset\uparrow{\mathrm O}}}\;_{(\mathrm l)}
- මෙහිදී C හා O වල ඔක්සිකරණ අංක වෙනස් වේ.
- H වල ඔක්සිකරණ අංකය වෙනස් නොවේ.
- C වල සමුච්චිත ඔක්සිකරණ අංකය -4 සිට +4 දක්වා වෙනස් වේ.
- එබැවින් C ඔක්සිකරණය වේ.
- O වල සමුච්චිත ඔක්සිකරණ අංකය 0 සිට -2 දක්වා වෙනස් වේ.
- එබැවින් O ඔක්සිහරණය වේ.
- ඔක්සිකරණ ප්රතික්රියාව : CH4 හි කාබන් ඔක්සිකරණය වී CO2 නිපදවයි.
- එක් කාබන් පරමාණුවකින් ඉලෙක්ට්රොන 8ක් ඉවත් වේ.
- ඔක්සිහරණ ප්රතික්රියාව : ඔක්සිජන් ඔක්සිහරණය වී H2O හා CO2 නිපදවයි.
- එක් ඔක්සිජන් පරමාණුවක් ඉලෙක්ට්රොන 02ක් ලබාගනී.
උදාහරණ 03: CH2CH2 වලින් C2H6 සැදීම.
\underset{-2}{\underset\uparrow{\mathrm C\;}}{\mathrm H}_2\;\;\underset{-2}{\underset\uparrow{\mathrm C}}\;\;\;\underset{+1}{\underset\uparrow{{\mathrm H}_{2(\mathrm g)}}}+\;\underset0{\underset\uparrow{\mathrm H}}\;_{2(\mathrm g)}\rightarrow2\underset{-3}{\underset\uparrow{\mathrm C\;}}{\mathrm H}_3\;\;\underset{-3}{\underset\uparrow{\mathrm C}}\;\;\;\underset{+1}{\underset\uparrow{{\mathrm H}_{3(\mathrm g)}}}
- CH2CH2 හි C වල ඔක්සිකරණ අංක වෙනස් වේ.
- C පරමාණු තුනෙහි සමුච්චිත ඔක්සිකරණ අංකය -4 සිට -6 දක්වා වෙනස් වේ.
- එබැවින් C ඔක්සිහරණය වේ.
- H වල සමුච්චිත ඔක්සිකරණ අංකය 0 සිට +1 දක්වා වෙනස් වේ.
- එබැවින් H ඔක්සිකරණය වේ.
- ඔක්සිහරණ ප්රතික්රියාව : C2H4 ඔක්සිහරණය වී C3H6 නිපදවයි.
- මෙහිදී ඉලෙක්ට්රොන 2ක සමස්ත ප්රතිග්රහණයක් සිදුවේ.
- ඔක්සිකරණ ප්රතික්රියාව : මෙහිදී H2 ඔක්සිකරණය වේ.
- H2 වලින් ඉලෙක්ට්රොන දෙකක බැහැරවීමක් මෙහිදී සිදුවේ.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

