- සංයෝගයක් තාපය හමුවේ වියෝජනය වීම හෝ නොවීම යන ලක්ෂණයට හේතුවන්නේ එම සංයෝගයේ තාප ස්ථායිතාවය යි.
I කාණ්ඩයේ ලෝහ මූලද්රව්ය සාදන සංයෝගවල තාප ස්ථායිතාව
ඔක්සයිඩවල තාප ස්ථායිතාව
-
- S ගොනුවේ ලෝහ මූලද්රව්ය සාදන සියලු ඔක්සයිඩ තාප ස්ථායි බැවින් තාපය හමුවේ වියෝජනය නොවෙයි.
හයිඩ්රොක්සයිඩවල තාප ස්ථායිතාව
-
- I කාණ්ඩයේ ලෝහ අතරින් Li සාදන හයිඩ්රොක්සයිඩය පමණක් තාප අස්ථායි වන අතර එය තාපය හමුවේ වියෝජනය වී ඔක්සයිඩය හා ජලය සාදයි.
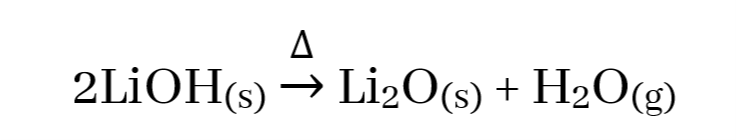
නයිට්රේටවල තාප ස්ථායිතාව
- Li සාදන නයිට්රේටය පමණක් දුඹුරු පැහැති NO2 වායුව, ඔක්සයිඩය හා O2 ලබාදෙමින් තාප වියෝජනය වෙයි.
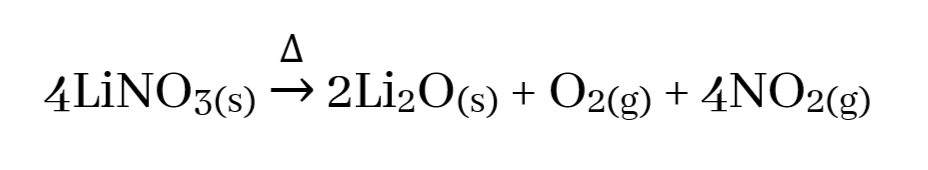
- Na, K, Rb, Cs යන සෙසු මූලද්රව්ය සාදන නයිට්රේට ද තාපය හමුවේ වියෝජනය වී එම ලෝහයේ නයිට්රයිටය සාදා O2 පිටකරයි.
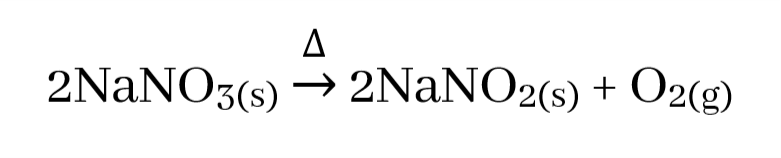
කාබනේටවල තාප ස්ථායිතාව
-
- I කාණ්ඩයේ Li සාදන කාබනේටය පමණක් තාප අස්ථායි බැවින් පහත ආකාරයට වියෝජනය වී සංයෝග ඇතිකරයි. සෙසු මූලද්රව්ය සාදන කාබනේට තාප ස්ථායි වේ.
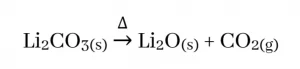
ඔක්සලේටවල තාප ස්ථායිතාව
-
- s ගොනුවේ ලෝහ මූලද්රව්ය සාදන ඔක්සලේට සියල්ල තාප අස්ථායි බැවින් තාපය හමුවේ වියෝජනයෙන් ලෝහයේ කාබනේටය ඇතිකර CO වායුව පිටකරයි .
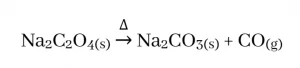
නමුත් I කාණ්ඩයේ ඔක්සලේට සැලකීමේදී Li2C2O4 වියෝජනයෙන් ඇතිවන කාබනේටය ද තාප අස්ථායි බැවින් එය ඔක්සයිඩය දක්වා වියෝජනය වී CO2 , COවශයෙන් අවසාන ප්රතිඵල ඇතිකරයි.
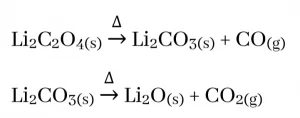
බයිකාබනේටවල තාප ස්ථායිතාව
-
- S ගොනුවේ කාණ්ඩ දෙකෙහිම ලෝහ බයිකාබනේට තාප අස්ථායි වන අතර වියෝජනය වී ලෝහයේ කාබනේටය , CO2 හා H2O ඇතිකරයි.
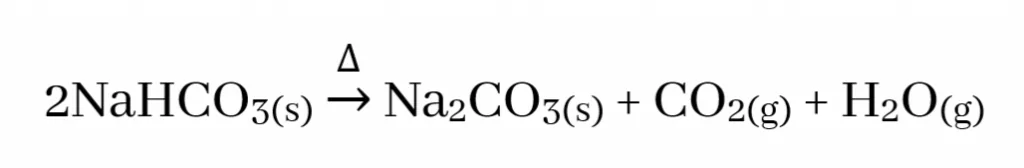
- නමුත් I කාණ්ඩය පමණක් සැලකීමේදී Li2CO3 තාප අස්ථායි වන අතර වියෝජනය වී ලෝහයේ ඔක්සයිඩය , CO2 හා H2O වශයෙන් අවසාන ප්රතිඵල ඇතිකරයි.
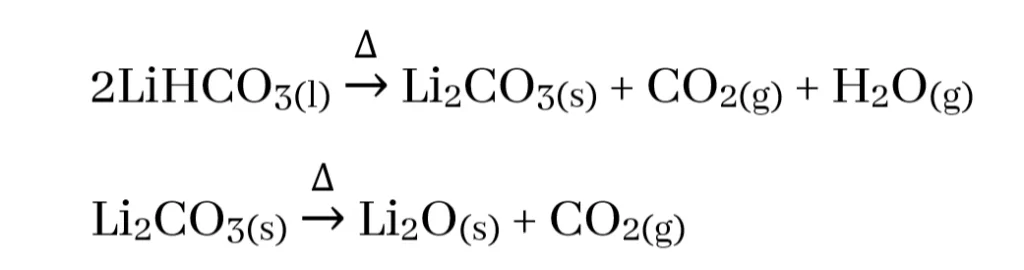
- LiHCO3 හා 2 කාණ්ඩයේ සියලු බයිකාබනේටවල වියෝජන උෂ්ණත්වය 100°C ට වඩා අඩු නිසා ඒවා ඝන තත්වයෙන් ලබාගත නොහැකි අතර ජලීය ද්රාවණ තුළ පමණක් පවතියි.
දෙවන කාණ්ඩයේ ලෝහ මූලද්රව්ය සාදන සංයෝගවල තාප ස්ථායිතාව
- තාපස්ථායිතාවය සදහා බලපාන්නේ කිසියම් ආරෝපිත අංශුවක ධ්රැවීකරණ බලය යි .
- කිසියම් ආරෝපිත අංශුවක හෝ අයනයක එක ආරෝපණ බෙදීමක් ඇති වීම එම පරමාණුවේ හෝ අයනයේ ධ්රැවණශීලීතාවය නම් වේ. මෙය බලපාන්නේ ඇනායන සදහා පමණි.
- මේ අනුව ධන ආරෝපිත අංශුවක ආරෝපණය වැඩි වන විට සහ අරය අඩු වන විට ධ්රැවීකරණය වැඩි වේ .
- ධ්රැවීකරණ බලය වැඩි වන විට අයනික සංයෝගයේ අයනික ලක්ෂණ අඩු වන අතර එවිට තාප ස්ථායිතාවය අඩු වන නිසා තාප වියෝජනය පහසු වේ.
- මේ හේතුවෙන් 2 කාණ්ඩයේ ලෝහ සාදන කැටායන වල අරය කුඩා නිසා ධ්රැවීකරණ බලය වැඩි වී තාප වියෝජනය පහසු වේ. එනම් තාපස්ථායිතාවය, 1 කාණ්ඩයේ මූල ද්රව්යවලට වඩා මේවායේ අඩු වේ.
- පහත දැක්වෙන්නේ එක් එක් සංයෝග රත් කලවිට ලබාදෙන ප්රතිඵලයි.
කාබනේටවල තාපස්ථායිතාවය
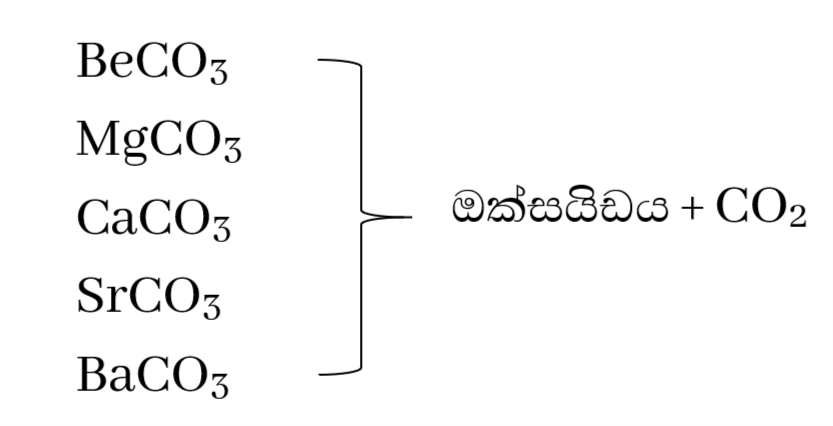
මෙහිදී රත් වීමෙන් කාබන්ඩයොක්සයිඩ් වායුව පිට වේ .
නයිට්රේටවල තාපස්ථායිතාවය
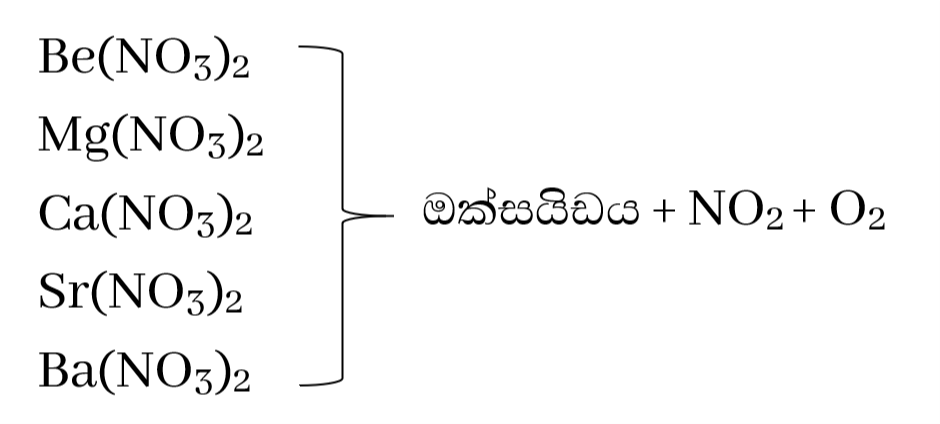
මේවා රත් වීම මඟින් ඔක්සිජන් වායුව සහ නයිට්රජන්ඩයොක්සයිඩ් වායුව පිට කරයි .
හයිඩ්රොක්සයිඩවල තාපස්ථායිතාවය
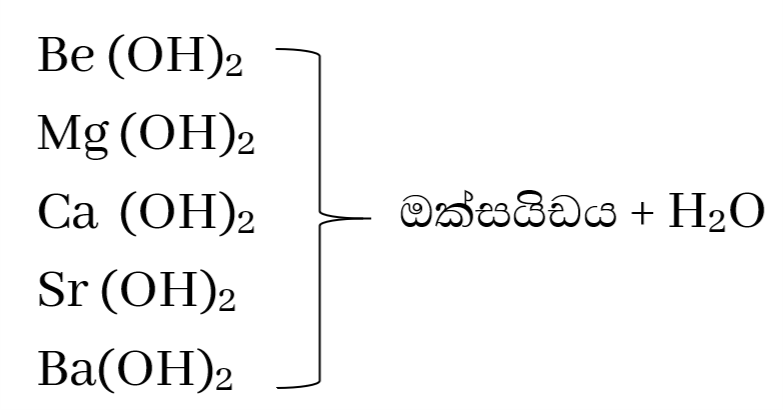
මේවා රත් වීම මඟින් ඔක්සයිඩය සමග සමග ජල වාෂ්ප ලබාදේ .
බයිකාබනේට්වල තාපස්ථායිතාවය
-
- දෙවන කාණ්ඩයේ සියලු බයිකාබනේට ජලීය ද්රාවණවලදී පමණක් ස්ථායිව පවතී. ඒවා රත් කරන විට ජල අද්රාව්ය කාබනේට සාදමින් වියෝජනය වේ. ඊට අමතරව කාබන්ඩයොක්සයිඩ් වායුව සහ ජලය සෑදෙයි.
Ca(HCO3)2 → CaCO3 + CO2 + H2O
සල්ෆේටවල තාප ස්ථායිතාවය
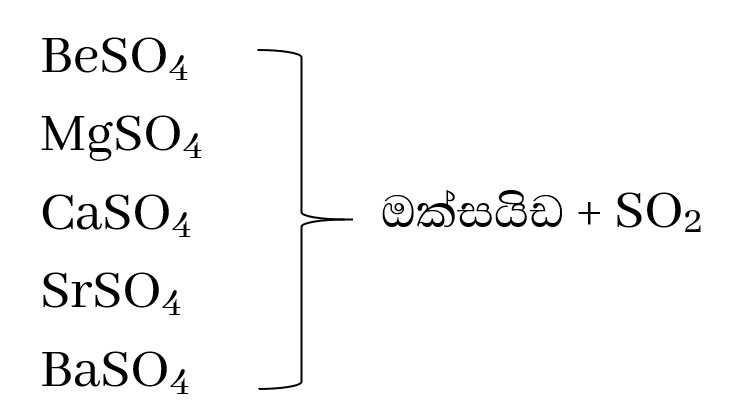
මෙම සංයෝග රත් වීම මඟින් ඔක්සයිඩය සමඟ සල්ෆර්ඩයොක්සයිඩ් වායුව ලබා දෙයි.

