ලුවිස් තිත් සටහන් හා ලුවිස් තිත් – ඉරි ව්යූහ
අණු හා අයන කණ්ඩවල සංයුජතා ඉලෙක්ට්රෝන සකස් වී ඇති ආකාරය දැක්වෙන සටහන් ලුවිස් සටහන් ලෙස හදින්වේ.
සංයුජතා ඉලෙක්ට්රෝන ලෙස බොහෝවිට සැලකෙන්නේ අවසාන ශක්ති මට්ටමේ ඉලෙක්ට්රෝනයයි.
බන්ධන ඉලෙක්ට්රෝන යුගල ඉරකින් පෙන්වීම ලුවිස් තිත්-ඉරි ව්යූහ වන අතර එම ඉලෙක්ට්රෝන යුගල තිත් වලින් පෙන්වීම ලුවිස් තිත් සටහන් වේ.
ලුවිස් සටහන් ඇඳීමේදී පහත පියවර අනුගමනය කෙරේ.
- මධ්ය පරමාණුව තෝරා ගැනීම. මෙහිදී විද්යුත් සෘණතාවය අඩු පරමාණුව (H හා F හැර) තොරා ගැනේ.
- H හා F යන ඒක සංයුජ මූලද්රව්ය පරමාණු සාමාන්යයෙන් මධ්ය පරමාණු බවට පත් නොවේ. මධ්ය පරමාණු බවට පත් වන්නේ බන්ධන කීපයක් සෑදිය හැකි මූලද්රව්ය පරමාණුය.
- රසායනික සූත්රයේ සියලු පරමාණු වල සංයුජතා කවච ආශ්රිත මුලු ඉලෙක්ට්රෝන සංඛ්යාව ගණනය කිරීම. නිදසුනක් ලෙස H2O හි O මගින් ඉලෙක්ට්රෝන 6 ක්ද H පරමාණුවකින් එක ඉලෙක්ට්රෝනය බැගින් පරමාණු දෙකෙන් ඉලෙක්ට්රෝන 2ක් ද සැපයෙන නිසා මුලු ඉලෙක්ට්රෝන ගණන 8 වේ. සෘණ අයනයක් නම් සෘණ ආරෝපණ ගණනට සමාන ඉලෙක්ට්රෝන ගණනක් එකතු කල යුතු අතර ධන අයනයක් නම් ධන ආරෝපණ ගණනට සමාන ඉලෙක්ට්රෝන ගණනක් අඩු කල යුතුයි.
- බන්ධන නිරූපණය කිරීමට පර්යන්ත පරමාණු හා මධ්ය පරමාණු අතර තිත් යුගලක් බැගින් හෝ ඉරි මඟින් දැක්වීම.
- බන්ධන ඉලෙක්ට්රෝන යුගල එලෙස ලකුණු කිරීමෙන් පසුව ඉතිරි වන ඉලෙක්ට්රෝන පර්යන්ත පරමාණු මත අෂ්ටකය සම්පූර්ණ වන ලෙස තිත් යුගල බැගින් සලකුණු කිරීම. පර්යන්ත පරමාණුව H නම් එහිදී H මත ඉලෙක්ට්රෝන ලකුණු කිරීමක් සිදු නොවේ.
- පර්යන්ත පරමාණු මත එකසර යුගල් සටහන් කල පසු තවත් ඉලෙක්ට්රෝන යුගල් ඉතිරි වේ නම්, එහි මධ්ය පරමාණුව මත එම ඉලෙක්ට්රෝන යුගල සලකුණු කිරීම.
- ඉලෙක්ට්රෝන සටහන් කිරීමෙන් පසුව එක් එක් පරමාණුව වටා ඇති ඉලෙක්ට්රෝන සංඛ්යාව නිදහස් පරමාණුක අවස්ථාවේ වූ සංයුජතා කවච ඉලෙක්ට්රෝන සංඛ්යාව සමඟ සසඳා ආරෝපිත තත්ත්වය (විධිමත් ආරෝපණය) සලකුණු කිරීම. මෙහිදී ඉලෙක්ට්රෝන අෂ්ටකය සම්පූර්ණ වීම වැදගත් වේ. බන්ධනයකින් එක ඉලෙක්ට්රෝනයක්ද එකසර යුගල් වල ඉලෙක්ට්රෝන දෙකමද එම පරමාණුවට අයත් යැයි සැලකේ. නිදසුනක් ලෙස NH2–අයනය සලකමු.
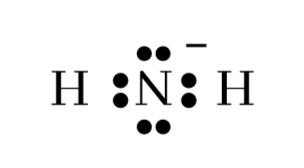
මෙහි N පරමාණුව වටා ඉලෙක්ට්රෝන අටකි. නයිට්රජන් පරමාණුව ඉලෙක්ට්රෝන 5ක් සපයා ඇතත් ඉහත ව්යූහයට අනුව N මඟින් ඉලෙක්ට්රෝන 6ක් සපයා ඇත. එක් ඉලෙක්ට්රෝනයක් වැඩිපුර සපයා ඇති නිසා N හි විධිමත් ආරෝපණය -1කි. එම ආරෝපණය N පරමාණුව අසලින් සටහන් කර ඇත.
- පරමාණු මත පවතින ආරෝපණ අවම වන පරිදි හා අෂ්ටකය පූර්ණ වන පරිදි ඉලෙක්ට්රෝන ව්යාප්තිය ප්රතිසංවිධානය කිරීම සිදු කල යුතුයි. මෙහිදි එකසර යුගල බන්ධන යුගල බවට ප්රතිසංවිධානය කල යුතුයි.
නිදසුනක් ලෙස SO32- අයනය සලකමු.
මුලු ඉලෙක්ට්රෝන ගණන – S වලින් 6, O එකකින් 6 බැඟින් O පරමාණු 3න් 18 යි, සෘණ 2 ආරෝපණය නිසා ඉලෙක්ට්රෝන 2 යි. මුලු එකතුව 26 යි.
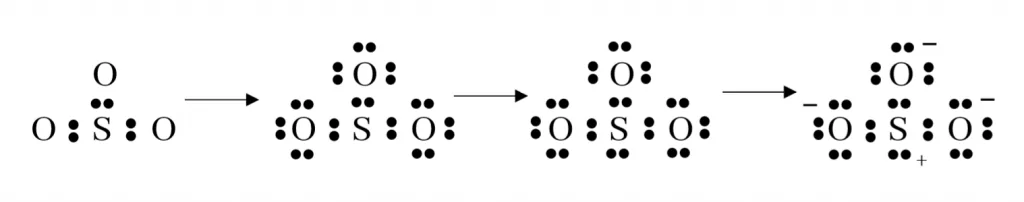
මෙහි අවසාන ව්යූහයේ සැම පරමාණුවක්ම අෂ්ටකය සම්පූර්ණ කර ඇතත් විධිමත් ආරෝපණ ව්යාප්තිය උපරිම වී ඇති නිසා එය ස්ථායි නොවේ. එම නිසා විධිමත් ආරෝපණ ව්යාප්තිය අවම කර ගැනීමට පහත ලෙස ප්රතිසංවිධානය කල යුතු වේ.

මෙහි සල්ෆර් වටා ඉලෙක්ට්රෝන 10ක් ඇත. එනම් අෂ්ටක නියමයට පටහැනි වේ. එයට හේතුව සල්ෆර් වල හිස් d කාක්ෂික තිබීමයි.
එමනිසා සමහර මධ්ය පරමාණු අෂ්ටක නියමයට පටහැනිව හැසිරේ. සමහරක 8කට වඩා අඩුවෙන්ද (Al, B), සමහරක 8 කට වඩා වැඩියෙන්ද තිබිය හැක.(3වන ආවර්තයේ)
දෙවන ආවර්තයේ මූලද්රව්යයක අෂ්ටකය ඉක්මවිය නොහැක.
|
සූත්රය |
සංයුජතා කවච ඉලෙක්ට්රෝන ගණන |
ලුවිස් තිත් සටහන |
ලුවිස් තිත් – ඉරි ව්යුහ |
|
CO2 |
16 |
 |
 |
|
POCl3 |
32 |
 |
 |
|
HCN |
10 |
 |
 |
|
NO2– |
18 |
 |
 |
|
NO3– |
24 |
 |
 |
|
NO2+ |
16 |
 |
 |
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

