සම්ප්රයුක්තතාවය
කාලයත් සමඟ හදුනාගත් සමහර රසායනික ප්රභේද වල ගුණ එක් සරල ලුවිස් ව්යූහයකින් පැහැදිලි කළ නොහැකි විය. එම ප්රභේදයන්හි ගුණ පැහැදිලි කිරීම සඳහා ස්ථායි ලුවිස් ව්යූහ 2 ක් හෝ වැඩි සංඛ්යාවක් අවශ්ය වනු ඇත.
උදා – O3
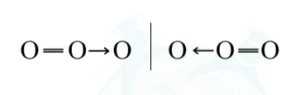
හඳුනාගෙන ඇති ආකාරයට O තනි බන්ධනයක බන්ධන දිග 147pm ද O ද්විත්ව බන්ධනයක බන්ධන දිග 121pm ද වේ. එනම් O3 හි ලුවිස් ව්යූහයේ O පරමාණු අතර ඒක බන්ධනයේ බන්ධන දිග 147pm ද ද්විත්ව බන්ධනයේ බන්ධන දිග 121pm ද විය යුතු වේ.
කෙසේ වෙනත් විශ්ලේෂණය මගින් හඳුනාගෙන ඇත්තේ O3 හි බන්ධන දිගවල් 2 ම සර්වසම වන අතර එය 128pm බැඟින් වන බවයි.
O3 හි සැබෑ ව්යූහය එය ඈඳ ඇති ලුවිස් ව්යූහ 2ම නොවන බව මෙයින් ගම්ය වේ.
මේ ආකාරයට ලුවිස් ව්යූහ 2 ක හෝ වැඩි ප්රමාණයක සංකලනයකින් කිසියම් රසායනික ප්රභේදයක් සතුව ගැබ්ව පවතින ගුණ පැහැදිලි කිරීමේ සංසිද්ධිය සම්ප්රයුක්තතාවය ලෙසත්, අදාළ ප්රභේදයේ සත්ය ව්යූහය ගොඩනැංවිමේදී සංකලනය වන වෙනස් ලුවිස් ව්යූහ එම ප්රභේදයේ සම්ප්රයුක්ත ව්යූහ ලෙසත්, සම්ප්රයුක්ත ව්යූහ සංකලනය වීමෙන් ගොඩනැගෙතැයි අපේක්ෂිත සෛද්ධාන්තික සත්ය ව්යූහය ප්රභේදයේ සම්ප්රයුක්ත මුහුම ලෙසත් හැඳින්වේ.
අණුවක් හෝ අයනයක් සම්ප්රයුක්ත ව්යූහ දැක්වීම සදහා පහත සදහන් අවශ්යතාවයන් සපුරාලිය යුතුය.
- සලකන ලද පරමාණුව වටා π බන්ධනයක් ( ද්විත්ව බන්ධනයක් හෝ ත්රිත්ව බන්ධනයක්) පැවතිය යුතුය.
- එම පරමණුවට එක් එකසර යුගලක් හෝ සහිත වෙනත් පරමාණුවක් බැදී තිබිය යුතුය.
සම්ප්රයුක්ත ව්යූහ
සම්ප්රයුක්තතාවය පෙන්වන ප්රභේදයක සත්ය ව්යූහය ගොඩනැංවිමේදී සංකලනය වන වෙනස් ලුවිස් ව්යූහ එම ප්රභේදයේ සම්ප්රයුක්ත ව්යුහ ලෙස හැඳින්වේ.
කිසියම් රසායනික සූත්රයකට අදාලව අඳිනු ලබන ලුවිස් ව්යූහයක් අදාළ ප්රභේදයේ සම්ප්රයුක්ත ව්යූහයක් බවට පත්වීමට එම ලුවිස් ව්යූහය අනෙකුත් සම්ප්රයුක්ත ව්යූහ සමඟ පහත මූලික අවශ්යතා 3 තෘප්ත කර පැවතිය යුතුය.
- අඳිනු ලබන ලුවිස් ව්යූහයක පරමාණු සැකිල්ල අනෙකුත් සම්ප්රයුක්ත ව්යූහවල පරමාණු සැකිල්ලට සර්වසම වීම
- අඳිනු ලබන ලුවිස් ව්යූහයේ මුලු අරෝපණය සෙසු සම්ප්රයුක්ත ව්යූහ වල මුලු ආරෝපණයට සමාන විය යුතුයි.
- අඳිනු ලබන ලුවිස් ව්යූහය සතු මුලු ඉලෙක්ට්රෝන ප්රමාණය අනෙකුත් සම්ප්රයුක්ත ව්යූහවල මුලු ඉලෙක්ට්රෝන ප්රමාණයට සමාන විය යුතුයි.
මෙම අවශ්යතා 3 සම්පූර්ණ කරනු ලබන කිසියම් ප්රභේදයක් සඳහා වන සම්ප්රයුක්ත ව්යූහ අතර සැබෑ ව්යූහය ගොඩනැංවිමේදී ඒවා සංකලනය වේ යන අදහස ඇතිව දෙපසට යොමුවූ ඊතල («) යොදනු ලැබේ.
සම්ප්රයුක්තතාවයේ ලක්ෂණ
- සම්ප්රයුක්ත ව්යූහ, ස්වභාවයේ සත්ය ලෙස නොපවති. අණු, අයනවල සත්ය ස්වභාවය වටහා ගැනිමේ පහසුව තකා අඳිනු ලබයි.
-
එනම් ස්වභාවයේ පවතින්නේ සම්ප්රයුක්ත මුහුම් ව්යූහයයි.
- එක සමාන සම්ප්රයුක්ත ව්යූහ ඇතිවිටදී සම්ප්රයුක්ත මුහුමේ බන්ධන දිග එක සමාන වේ.
උදා – NO2– හි N-O බන්ධන දිග එක සමාන වීම
- සම්ප්රයුක්ත මුහුමේ ස්ථායිතාවය අනෙකුත් සම්ප්රයුක්ත ව්යූහ වලට වඩා වැඩි වන්නේ එයට සාපේක්ෂව අඩු ශක්තියක් ඇති නිසාය.
- සමාන සම්ප්රයුත්ක ව්යූහ සම්ප්රයුක්ත මුහුමට සමාන දායකත්වයක් දෙයි.
- සම්ප්රයුක්ත මුහුම සෑදීම සදහා දායක වන්නේ ශක්තියෙන් සමාන හෝ සුළු වශයෙන් වෙනස් සම්ප්රයුක්ත ව්යූහ වන අතර ශක්තියෙන් බොහෝ සෙයින් ඉහළ අස්ථායි ව්යූහ මුහුම සදහා දායකත්වය නොසලකා හැරිය හැක.
විධිමත් ආරෝපණය
- අණුවක/ බහු පරමාණුක අයනයක ඇති පරමාණුවක් මත පවතින මනඃකල්පිත අරෝපණය වේ.
- මෙය සලකා බලන්නේ ශක්තිමය වශයෙන් වඩාත් ස්ථායි ලුවිස් ව්යූහය සොයා ගැනීමටයි.
- සාමාන්යයෙන් සෑම පරමාණුවක් මතම විධිමත් ආරෝපණය ශූන්ය හෝ ශූන්යට ආසන්න වේනම් එය ස්ථායි ව්යූහයක් ලෙස සැලකේ.
විධිමත් ආරෝපණය = පරමාණුවේ සංයුජතා ඉලෙක්ට්රෝන ගණන – (බන්ධන ගණන + එකසර යුගල වල ඉලෙක්ට්රෝන ගණන)
- අණුවක විධිමත් ආරෝපණ වල එකතුව ශූන්ය වේ.
- බහු පරමාණුක අයනයක , විධිමත් අරෝපණ වල එකතුව අයනයේ ආරෝපණයට සමාන වේ.
දෙනු ලබන ප්රභේදයක් සඳහා සම්ප්රයුක්ත ව්යූහ ගොඩනැගීම
කේන්ද්රගත පරමාණු එකක් පමණක් ඇතිවිට.
- සම්ප්රයුක්ත ව්යූහ ගොඩනැගීමට නියමිත ප්රභේදයේ පරමාණු සැකිල්ල පිහිටුවීම.
- සම්ප්රයුක්ත ව්යූහ ගොඩනැගීමට නියමිත ප්රභේදයේ මුලු එකසර ඉලෙක්ට්රෝන සංඛ්යාව නිර්ණය කිරීම. (මුලු සංයුජතා ඉලෙක්ට්රෝන සංඛ්යාවෙන් බන්ධන සඳහා සහබාගි වූ ඉලෙක්ට්රෝන සංඛ්යාව අඩු කල යුතුය)
- මෙම එකසර ඉලෙක්ට්රෝන සංඛ්යාව අග්රස්ථ පරමාණුවලට ස්ථායි ඉලෙක්ට්රෝන වින්යාස (අෂ්ටකය) ලැබෙන තෙක් ස්ථානගත කිරීම. එවිට ඉලෙක්ට්රෝන ඉතිරි වූයේ නම් මධ්ය පරමාණුව මත ස්ථානගත කිරීම.
- අදාල පරමාණුවල ආරෝපණ සටහන් කිරීම
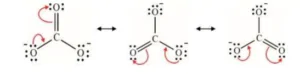
- කේන්ද්රගත පරමාණුවෙහි ස්ථායිකරණය පිණිස උචිත පරිදි එකසර ඉලෙක්ට්රෝන යුගල සහ π බන්ධන සංක්රමණය කරවමින් සම්ප්රයුක්ත ව්යූහ එකින් එක ගොඩනැගීම. (කේන්ද්රගත පරමාණුව 2වන ආවර්තයේ නම් එහි ස්ථායිකරණය ලෙස සැලකෙන්නේ ඉලෙක්ට්රෝන අෂ්ටකය සම්පූර්ණ වීම වන අතර 3 වන ආවර්තයේ සිට පහළ ආවර්තවලදී අරෝපණ සටහනෙහි එය මත ප්රේරණය වන ආරෝපනය උදාසීන වීමයි.)
- එකසර ඉලෙක්ට්රෝන යුගල සහ π බන්ධනවල සංක්රමණය පෙන්වීමට නැමි ඊතල භාවිතා කරන අතර ඉලෙක්ට්රෝන යුගල සංක්රමණය වූ ස්ථානය ඊ හිස මගින් නිරූපණය වේ.(මෙලෙස නැමි ඊතල යෙදීම අනිවාර්ය නැත.)
1. CO32-හි පරමාණු සැකිල්ල පහත දැක්වේ.
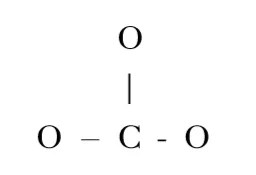
CO32- සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
අභ්යාස
2. HCO3– හි පරමාණු සැකිල්ල පහත දැක්වේ.
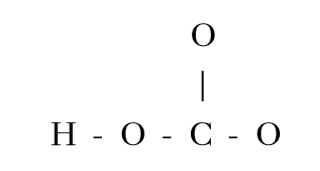
HCO3– සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
3. NO3–හි පරමාණු සැකිල්ල පහත දැක්වේ.
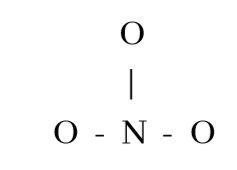
NO3– සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
4. SO42- හි පරමාණු සැකිල්ල පහත දැක්වේ.
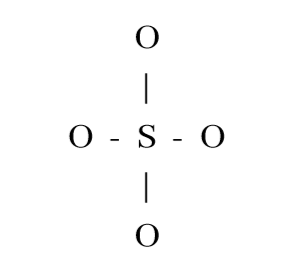
SO42- සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
කේන්ද්රගත පරමාණු එකකට වඩා ඇති විට වරකට එක් කේන්ද්රගත පරමාණුව බැගින් සලකා සම්ප්රයුක්ත ව්යූහ ගොඩනගමින් ලැබෙන්නාවූ එකිනෙකට වෙනස් සම්ප්රයුක්ත ව්යූහ සියල්ල අවසානයේදි නිරූපණය කල යුතු වේ.
- CH3SCN හි පරමාණු සැකිල්ල පහත දැක්වේ.
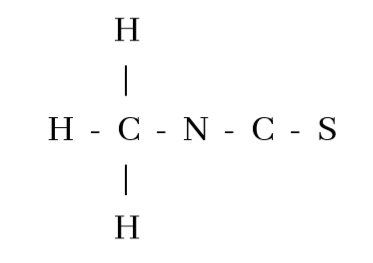
CH3SCN සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
CH3SCN අණුවේ N පරමාණුව හා N හා S ට බැඳුණු C පරමාණුව කේන්ද්රගත පරමාණු ලෙස හඳුනාගත හැක
- N පරමාණුව කේන්ද්රගත පරමාණුව ලෙස සැලකූ විට,
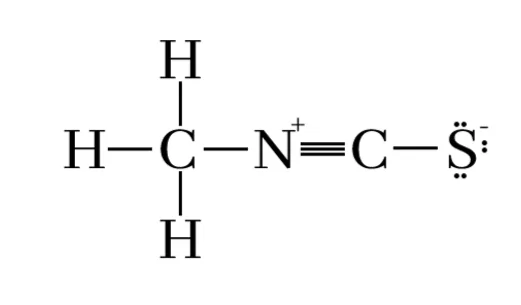
- N හා S ට බැඳුනු C පරමාණුව කේන්ද්රගත පරමාණුව ලෙස සැලකූ විට,
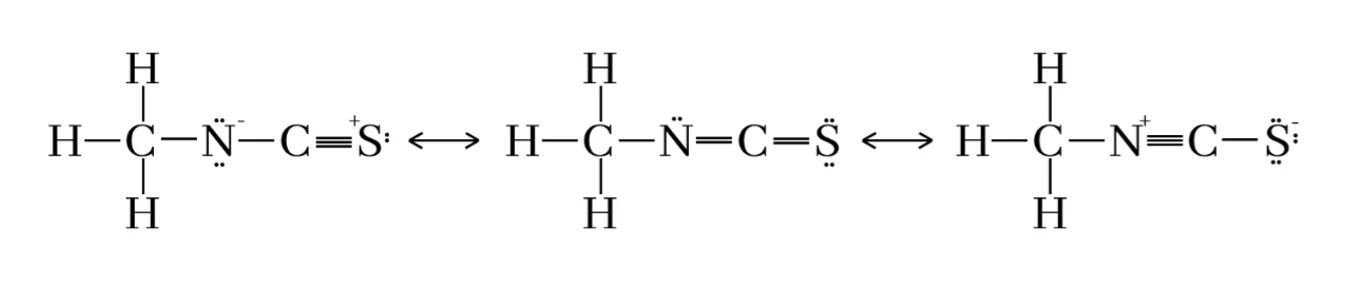
- කේන්ද්රගත පරමාණු දෙකට වෙන වෙනම සම්ප්රයුත ව්යූහ ඇඳ ඇති විට මුලු ව්යූහ 4 ක් ඇති නමුත් ඉන් 2ක් සර්වසම වීම නිසා එකිනෙකට වෙනස් වූ ව්යූහ ඇත්තේ 3 කි.
අභ්යාස
2. (CH3)2N2O හි පරමාණු සැකිල්ල පහත දැක්වේ.
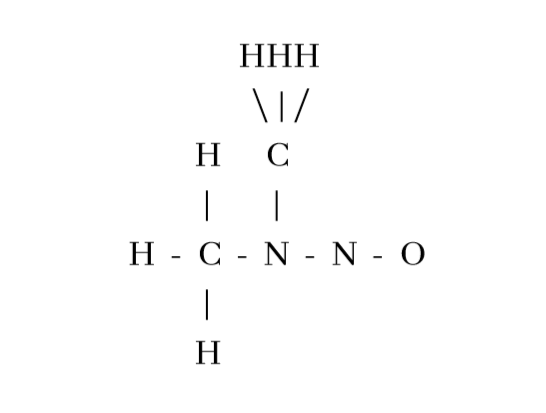
(CH3)2N2O සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න
3. [OONO]– හි පරමාණු සැකිල්ල පහත දැක්වේ.
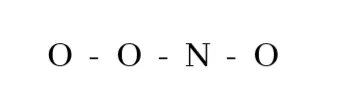
[OONO]– සඳහා ඇදිය හැකි සම්ප්රයුක්ත ව්යූහ සියල්ල ඇඳ දක්වන්න.
කේන්ද්රගත පරමාණු එකක් හෝ කීපයක් පවතින ඕනෑම අවස්ථාවකදී අග්රස්ත පරමාණු වල ද ඉලෙක්ට්රෝන අෂ්ටකය සම්පූර්ණ නොවේ නම් ඒවායේද මධ්ය පරමාණුවේ ආකාරයට ස්ථායිකරණය සැලකිය යුතුයි.
4. [CNO3]+ හි පරමාණු සැකිල්ල පහත දැක්වේ.
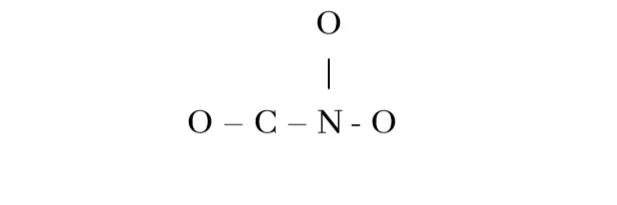
[CNO3]+ සඳහා පැවතිය හැකි සියලුම සම්ප්රයුක්ත ව්යූහ ගොඩනඟන්න.
සම්ප්රයුක්ත ව්යූහ 2 ක සාපේක්ෂ ස්ථායිතා සංසන්දනය කිරීම.
දෙනු ලබන ප්රභේදයක් සඳහා නිර්මාණය කරන සම්ප්රයුක්ත ව්යූහවල සාපේක්ෂ ස්ථායිතා සංසන්දනය කිරීමේදී සැලකිල්ලට ගනු ලබන මූලික කරුණු 4 ක් දක්නට ලැබේ.
- සංඝටක පරමාණු සියල්ලෙහි ඉලෙක්ට්රෝන වින්යාස ස්ථායි වූ ( අෂ්ටකය සම්පූර්ණ වූ) සම්ප්රයුක්ත ව්යූහයක ස්ථායිතාව එසේ නොවූ සම්ප්රයුක්ත ව්යූහයක ස්ථායීතාවයට වඩා සාපේක්ෂව වැඩියි.
- ව්යූහ තුළ විද්යුත් සෘණතාවය අඩු පරමාණු පවතින විට විද්යුත් සෘණතාවය වැඩි පරමාණු මත + ආරෝපණ ස්ථානගත වූ සම්ප්රයුක්ත ව්යූහ එසේ නොවන සම්ප්රයුක්ත ව්යූහවලට වඩා සාපේක්ෂව අස්ථායි බව සැලකේ.
- සමස්ත ආරෝපණය ගොඩනැගීමේදී වැඩි පරමාණු ප්රමාණයක් මත ආරෝපණ ව්යාප්ත වන සම්ප්රයුක්ත ව්යූහයක ස්ථායිතාවය, අඩු පරමාණු ප්රමාණයක් මත ආරෝපණ ව්යාප්ත වන සම්ප්රයුක්ත ව්යූහයක ස්ථායිතාවයට වඩා අඩු බව සැලකේ.
- අනුයාත පරමාණු 2ක් මත එකම වර්ගයේ අරෝපණ පවතින සම්ප්රයුක්ත ව්යූහයක ස්ථායිතාවය එසේ නොවන සම්ප්රයුක්ත ව්යූහයක ස්ථායිතාවයට වඩා අඩු බව සැලකේ.
කිසියම් දෙනු ලබන ප්රභේදයක් සඳහා සම්ප්රයුක්ත ව්යූහ නිශ්චිත ප්රමාණයක් ඇඳීමට කියයි නම් වඩාත් ස්ථායි ව්යූහ දැක්වීම යෝග්ය වේ.
උදා –
- HN3 හි පරමාණු සැකිල්ල පහත දැක්වේ.
H – N – N – N
HN3 සඳහා සම්ප්රයුක්ත ව්යූහ ඇඳ ඒවායේ සාපේක්ෂ ස්ථායිතා සංසන්දනය කරන්න.
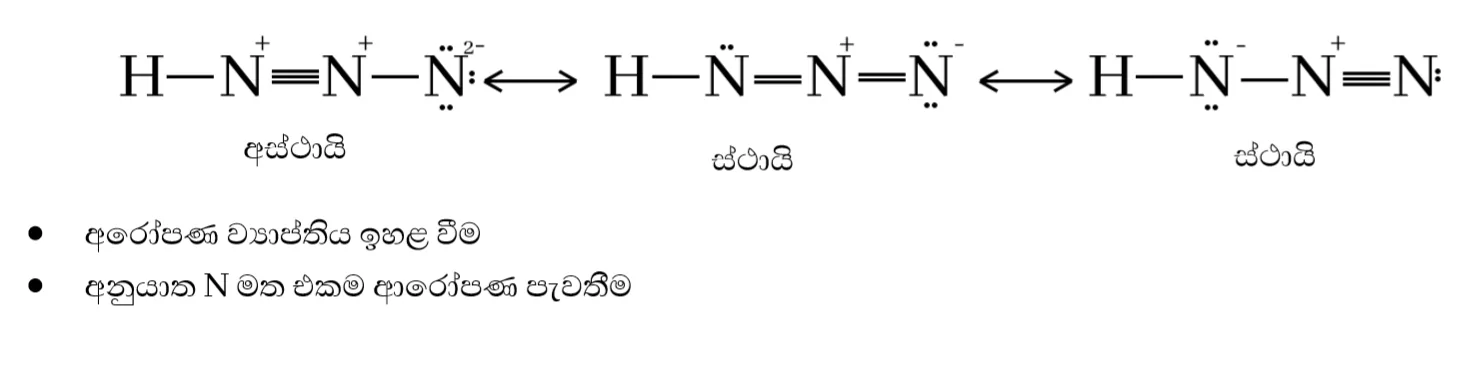
අභ්යාස
2. N2O4 හි පරමාණු සැකිල්ල පහත දැක්වේ.
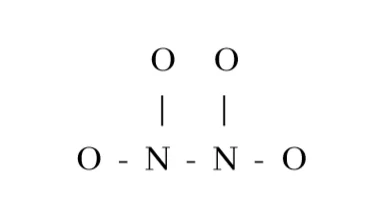
N2O4 සඳහා සම්ප්රයුක්ත ව්යූහ ඇඳ ඒවායේ සාපේක්ෂ ස්ථායිතා සංසන්දනය කරන්න.
3. H2N-NO2 හි පරමාණු සැකිල්ල පහත දැක්වේ.
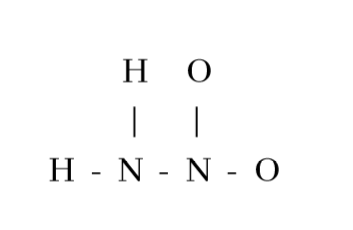
H2N-NO2 සඳහා සම්ප්රයුක්ත ව්යූහ ඇඳ ඒවායේ සාපේක්ෂ ස්ථායිතා සංසන්දනය කරන්න.
4. CH3NO2 හි පරමාණු සැකිල්ල පහත දැක්වේ.
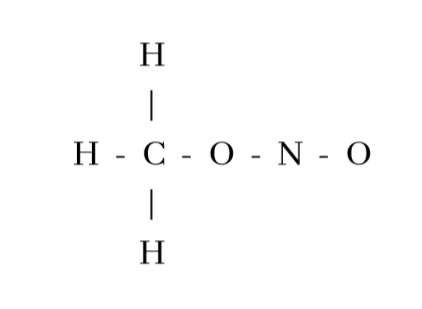
CH3NO2 සඳහා සම්ප්රයුක්ත ව්යූහ ඇඳ ඒවායේ සාපේක්ෂ ස්ථායිතා සංසන්දනය කරන්න.
බන්ධන පෙල
දෙනු ලබන ප්රභේදයක සලකන ලද පරමාණු දෙකක් අතර මුහුම සෑදීම සදහා දායක වන එක් එක් සම්ප්රයුක්ත ව්යූහවල පවතින මුළු බන්ධන ඉලෙක්ට්රෝන යුගල සංඛ්යාවේ එකතුව මුහුම සෑදීම සදහා දායක වන සම්ප්රයුක්ත ව්යූහ සංඛ්යාවෙන් බෙදීමෙන් ලැබෙන අගය එම පරමාණු දෙක අතර බන්ධනයේ බන්ධන පෙළ නම් වේ.
දෙනු ලබන ප්රභේදයක් සඳහා සම්ප්රයුක්ත මුහුම නිර්මාණය කිරීම
දෙනු ලබන ප්රභේදයක් සඳහා සම්ප්රයුක්ත මුහුම යනු එහි ස්ථායි සම්ප්රයුක්ත ව්යූහ සංකලන වීමෙන් ගොඩනැගේ යැයි අපේක්ෂිත සාරාංශගත තනි ව්යූහයයි.
- සම්ප්රයුක්ත මුහුමක් ගොඩනැගීමේදී සම්ප්රයුක්ත ව්යූහවල ආකාරයටම පරමාණු සැකිල්ල පිහිටුවා සෑම ස්ථායි සම්ප්රයුක්ත ව්යූහයක්ම පවතින බන්ධන හෙවත් ස්ථායි බන්ධන තනි ඉරකින්ද ඇතැම් ස්ථායි සම්ප්රයුක්ත ව්යූහවල නොපවතින බන්ධන හෙවත් අස්ථාවර බන්ධන කඩ ඉරිවලින් ද නිරූපණය කළ යුතුය.
- ස්ථායි සම්ප්රයුක්ත ව්යූහ තුල ඒ ඒ පරමාණුව මත සෑම අවස්ථාවකදීම පැවති උපරිම එකසර ඉලෙක්ට්රෝන යුගල ගණන දැක්විය යුතුයි
- අවසාන වශයෙන් කිසියම් පරමාණුවක් සියලු ස්ථායි සම්ප්රයුක්ත ව්යූහ තුල දැක්වූ මුලු ආරෝපනය ස්ථායි සම්ප්රයුක්ත ව්යූහ සංඛ්යාවෙන් බෙදූ විට ලැබෙන අගය ඒ ඒ පරමාණුව මත ආරෝපණය ලෙස අසලින් නිරූපණය කළ යුතු වේ.
උදා –
- CO32-සඳහා සම්ප්රයුක්ත ව්යූහ ඇද එහි සම්ප්රයුක්ත මුහුම නිර්මාණය කරන්න.
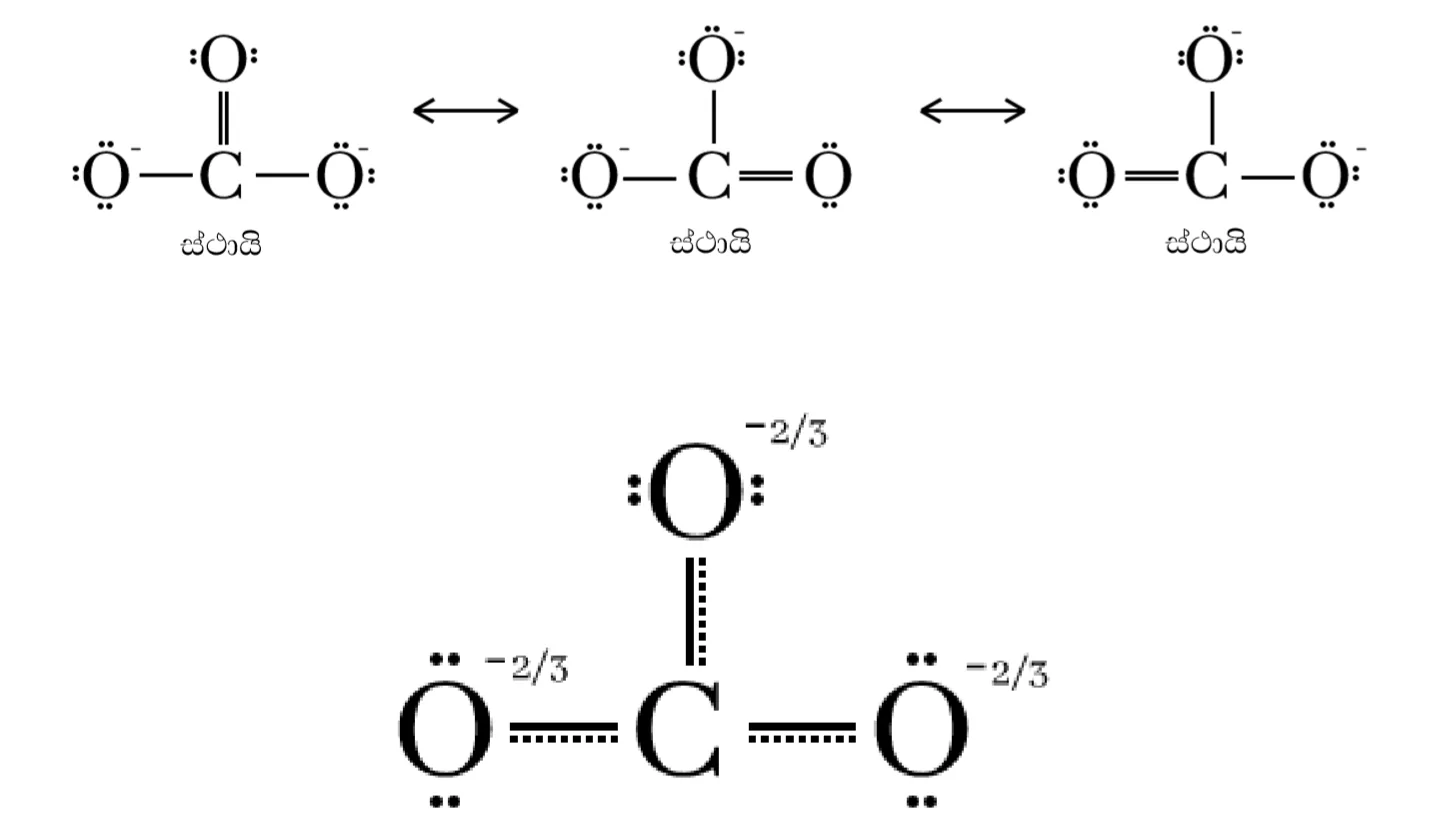
අභ්යාස
- NO3– සඳහා සම්ප්රයුක්ත ව්යූහ ඇද එහි සම්ප්රයුක්ත මුහුම නිර්මාණය කරන්න
- HCO3– සඳහා සම්ප්රයුක්ත ව්යූහ ඇද එහි සම්ප්රයුක්ත මුහුම නිර්මාණය කරන්න
සම්ප්රයුක්ත මුහුම් දෙකක ස්ථායිතා සංසන්දනය කිරීම
වැඩි ස්ථායි සම්ප්රයුක්ත ව්යූහ සංඛ්යාවක දායකත්වයෙන් ගොඩනැගෙන සම්ප්රයුක්ත මුහුමක ස්ථායිතාවය, අඩු සම්ප්රයුක්ත ව්යූහ ගණනක දායකත්වයෙන් ගොඩනැගෙන සම්ප්රයුක්ත මුහුමක ස්ථායිතාවයට වඩා වැඩි බව සැලකේ.
සම්ප්රයුක්තතා ස්ථායිකරණ ශක්තිය (සම්ප්රයුක්තා ශක්තිය)
සම්ප්රයුක්තතාවය පෙන්වන කිසියම් ප්රභේදයක වඩාත්ම ස්ථායි සම්ප්රයුක්ත ව්යූහය සතුව ගැබ්වන ශක්තියෙත්, එම ප්රභේදයේ සම්ප්රයුක්ත මුහුම සතුව ඇති ශක්තියෙත් ශක්ති වෙනස අදාල ප්රභේදය සඳහා වන සම්ප්රයුක්තතා ස්ථායිකරණ ශක්තිය ලෙස සැලකේ.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

