16 කාණ්ඩය – (ns2np4)
-
- මෙම කාණ්ඩයේ ඔක්සිජන්(O) සහ සල්ෆර්(S) අලෝහ වේ.
- කාණ්ඩයේ පහළට යන විට ලෝහමය ලක්ෂණ වැඩි වේ.
- නමුත් කාණ්ඩයේ අනෙක් සියලු මූලද්රව්ය ලෝහාලෝහ වේ.
- O පමණක් වායුමය ලෙස පවතී, අනිත් මූලද්රව්ය සියල්ල ඝන අවස්ථාවේ පවතියි.
- O හැර කාණ්ඩයේ අනෙකුත් මූලද්රව්යවලට -2 සිට +6 දක්වා වූ ඉරට්ටේ සංඛ්යා ඔක්සිකරණ අවස්ථා ලෙස දැක්විය හැකි ය. ඔක්සිකරණ අවස්ථාව +6 හා -2 ස්ථායීතාව කාණ්ඩයේ පහලට යත්ම අඩු වන අතර +4 ඔක්සිකරණ අවස්ථාවේ ස්ථායිතාව වැඩි වේ.
O – ඔක්සිජන් – 1s22s22p4
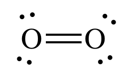 |
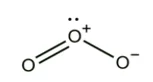 |
|
O2 අවර්ණ අගන්ධ වායුවකි. ජලයේ අල්ප වශයෙන් ද්රාව්ය වේ |
O3 ලා නිල් පැහැති වායුවකි. ඔක්සිකාරක ගුණය නිසා විෂබීජනාශක හා විරංජනකාරක ගුණ ඇත. කටුක ගන්ධයක් ඇත. |
- බහුරූපීතාව පෙන්නුම් කරන මූල ද්රව්යයකි.
- O2(ඩයිඔක්සිජන්) හා O3(ට්රයිඔක්සිජන්) ලෙස බහුරූපී ආකාර දෙකකි.
- විද්යාගාරයේ දී O2 නිෂ්පාදනය කරගැනීමට හැකි අයුරු
\begin{array}{l}2{{\mathrm{KMnO}}_4}_{(\mathrm s)}\xrightarrow\bigtriangleup{\mathrm K}_2{{\mathrm{MnO}}_4}_{(\mathrm s)}+{{\mathrm{MnO}}_2}_{(\mathrm s)}+{{\mathrm O}_2}_{(\mathrm g)}\\2{{\mathrm{KICO}}_3}_{(\mathrm s)}\xrightarrow{{\mathrm{MnO}}_2}2{\mathrm{KCl}}_{(\mathrm s)}+3{{\mathrm O}_2}_{(\mathrm g)}\\2{{\mathrm{PbO}}_2}_{(\mathrm s)}\xrightarrow\bigtriangleup2{\mathrm{PbO}}_{(\mathrm s)}+{{\mathrm O}_2}_{(\mathrm g)}\\2{\mathrm{HgO}}_{(\mathrm s)}\xrightarrow\bigtriangleup2{\mathrm{Hg}}_{(\mathrm l)}+{{\mathrm O}_2}_{(\mathrm g)}\\2{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm g)}\xrightarrow{{\mathrm{MnO}}_2}2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}+{{\mathrm O}_2}_{(\mathrm g)}\end{array}
ඔක්සිජන් අඩංගු සංයෝග
H2O – ජලය
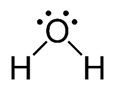
- ද්රාවකයක් ලෙස බහුලව භාවිතා වේ.
- H බන්ධන පවතින හෙයින් ඉහළ ද්රවාංක (O℃) හා තාපාංක (100℃) ඇත.
- H2O ආම්ලික, භාෂ්මික, ඔක්සිකාරක හා ඔක්සිහාරක ගුණය ඇත
\begin{array}{l}\text{ආම්ලික}\;\;\;\;\;\;\;\;2{\mathrm{Na}}_{(\mathrm s)\;}+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\;\rightarrow\;2{\mathrm{NaOH}}_{(\mathrm{aq})}+\;{{\mathrm H}_2}_{(\mathrm g)}\;\;\;\\\text{භාෂ්මික}\;\;\;\;\;\;\;\;\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;+\;{\mathrm{HCl}}_{(\mathrm{aq})\;}\rightarrow\;{\mathrm H}_3{\mathrm O^+}_{(\mathrm{aq})\;}+\;\mathrm{Cl}¯_{(\mathrm{aq})}\;\;\;\\\text{ඔක්සිකාරක}\;\;\;{\mathrm{Mg}}_{(\mathrm s)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;\mathrm{Mg}(\mathrm{OH}{)_2}_{(\mathrm{aq})}\;+\;{{\mathrm H}_2}_{(\mathrm g)\;}\;\;\\\text{ඔක්සිහාරක}\;\;\;\;\;{\mathrm K}_2{{\mathrm O}_2}_{(\mathrm s)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;2{\mathrm{KOH}}_{(\mathrm{aq})}\;+\;{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\;\;\;\\\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{{\mathrm{OF}}_2}_{(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;2{\mathrm{HF}}_{(\mathrm g)}\;+\;{{\mathrm O}_2}_{(\mathrm g)}\end{array}
H2O2 – හයිඩ්රජන් පෙරොක්සයිඩ්
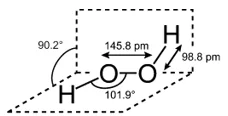
- ඝන පෙරොක්සයිඩයකට O℃ දී අම්ලයක් එක් කිරීමෙන් H2O2 සාදා ගත හැක.
{{\mathrm{BaO}}_2}_{(\mathrm s)}+{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}\xrightarrow{0^\circ\mathrm C}{{\mathrm{BaSO}}_4}_{(\mathrm s)}+{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}
- මෙහි OH කාණ්ඩ දෙක තල දෙකක පිහිටන නිසා අන්තර් අණුක H බන්ධන සාදා ගැනීමේ හැකියාව ජලයට වඩා ඉහළය. සාපේක්ෂව අණුක ස්කන්ධය ද H2O ට වඩා ඉහළය. මේ නිසා තාපාංකය (150℃) ජලයට වඩා ඉහළය.
- අණු ඇසිරීමේ පහසුවට අනුරූපව මෙහි ද්රවාංකය(-0.43℃) ජලයට වඩා අඩුය.
- ජලයට වඩා ඝණත්වයෙන්(1.4 g cm-3) ඉහළය.
- ප්රබල H බන්ධන නිසා H2O2 දුස්ස්රාවී ද්රව්යයකි.
- H2O2 අස්ථායීය. හිරු එළියට විවෘත වූ සැණින් O2 හා H2O බවට ද්විධාකරණය වේ.
2{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\;\rightarrow\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;+\;2{{\mathrm O}_2}_{(\mathrm g)}\;
- රොකට් එන්ජින් වල ඉන්ධනයක් ලෙස, විරංජනකාරකයක් හා විෂබීජනාශකයක් ලෙස යොදා ගැනේ.
- H2O2 ඔක්සිකාරකයක් හා ඔක්සිහාරකයක් ලෙස හැසිරේ.
ඔක්සිහාරකයක් ලෙස
- H2O2 හි O හි -1 ඔක්සිකරණ අවස්ථාව 0 ඔක්සිකරණ අවස්ථාවට පත්වේ.
{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\;\rightarrow\;{{\mathrm O}_2}_{(\mathrm g)}+\;2\mathrm e+2{\mathrm H^+}_{(\mathrm{aq})}
1. ආම්ලික KMnO4 සමඟ ප්රතික්රියාව.
-
-
- දම් පැහැති ජලීය KMnO4 ද්රාවණයකට H2SO4 එකතු කර H2O2 දැමූ විට දම් පැහැය අවර්ණ වී පැහැදිලි ද්රාවණයක් ලැබේ.
-
2{{\mathrm{KMnO}}_4}_{(\mathrm{aq})}+3{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+5{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow5{{\mathrm O}_2}_{(\mathrm g)}+2{{\mathrm{MnSO}}_4}_{(\mathrm{aq})}+{\mathrm K}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+8{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
2. භාෂ්මික KMnO4 සමඟ ප්රතික්රියාව
-
-
- දම් පැහැති භාෂ්මික (NH3) ද්රාවණයකට H2O2 එකතු කරන විට දම් පැහැය අවර්ණ වී කළු දුඹුරු පැහැති අවක්ෂේපය ලැබේ.
-
2{{\mathrm{KMnO}}_4}_{(\mathrm{aq})}+3{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow2{{\mathrm{MnO}}_2}_{(\mathrm s)}+3{{\mathrm O}_2}_{(\mathrm g)}+2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}+2{\mathrm{KOH}}_{(\mathrm{aq})}
3. ආම්ලික MnO2 සමඟ ප්රතික්රියාව
-
-
- H2SO4 වලින් ආම්ලික කළ කළු දුඹුරු පැහැති MnO2 ස්වල්පයක් එක් කළ විට වේගයෙන් වායු බුබුළු පිටවී අවසානයේදී අවර්ණ පැහැදිලි ද්රාවණයක් ලැබේ.
-
{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}+{{\mathrm{MnO}}_2}_{(\mathrm s)}\rightarrow{{\mathrm{MnSO}}_4}_{(\mathrm{aq})}+{{\mathrm O}_2}_{(\mathrm g)}+2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
4. ආම්ලික K2Cr2O7 සමඟ ප්රතික්රියාව
-
-
- H2SO4 වලින් ආම්ලික කළ තැඹිලි පැහැති ද්රාවණයකට H2O2 එක් කළ විට තැඹිලි පැහැති ද්රාවණය පළමුව නිල් පැහැයට හැරී, එය ක්ෂණිකව කොළ පැහැයට හැරේ. ප්රතික්රියාවේ අතරමැදියක් ලෙස Cr2O5 සෑදීම නිසා මෙම නිල් පැහැය ලැබේ.
-
{\mathrm K}_2{\mathrm{Cr}}_2{{\mathrm O}_7}_{(\mathrm{aq})}+4{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+3{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow\;{\mathrm{Cr}}_2{{\left({\mathrm{SO}}_4\right)}_3}_{(\mathrm{aq})}+{\mathrm K}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+{{\mathrm O}_2}_{(\mathrm g)}+7{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
ඔක්සිකාරකයක් ලෙස
- H2O2 හි O හි -1 ඔක්සිකරණ අවස්ථාව -2 ඔක්සිකරණ අවස්ථාව දක්වා අඩුවේ.
2{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}+2\mathrm e+2\mathrm H^+\rightarrow2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- ආම්ලික KI සමඟ ප්රතික්රියාව
- KI ජලීය ද්රාවණයකට (ළා කහ පැහැ) H2SO4 එක්කර මෙයට H2O2 එක් කළ විට ද්රාවණය ක්ෂණික රතු දුඹුරු (I3¯) පැහැයට හැරේ.
\begin{array}{l}2{\mathrm{KI}}_{(\mathrm{aq})}+{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow{{\mathrm I}_2}_{(\mathrm{aq})}+2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}+{\mathrm K}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})\;}\\{{\mathrm I}_2}_{(\mathrm{aq})}+{\mathrm{KI}}_{(\mathrm{aq})}\rightarrow{{\mathrm{KI}}_3}_{(\mathrm{aq})}\end{array}
- භාෂ්මික Cr(OH)3 සමඟ ප්රතික්රියාව
- කොළ පැහැති Cr(OH)3 අවක්ෂේපයට NaOH හා H2O2 දමා රත් කළ විට අවක්ෂේපය දියවී කහ පැහැති ද්රාවණයක් (CrO42¯) සෑදේ.
2\mathrm{Cr}(\mathrm{OH}{)_3}_{(\mathrm s)}+4{\mathrm{NaOH}}_{(\mathrm{aq})}+3{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\;\xrightarrow\triangle2{\mathrm{Na}}_2{{\mathrm{CrO}}_4}_{(\mathrm{aq})}+8{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- ආම්ලික FeSO4 සමඟ ප්රතික්රියාව
- ලා කොළ පැහැති ආම්ලික FeSO4 ද්රාවණයකට H2O2 එක් කළ විට දී Fe2+ , Fe3+ බවට පත්වීම නිසා කහ පැහැයට හැරේ.
2{{\mathrm{FeSO}}_4}_{(\mathrm{aq})}+{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}+{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow{\mathrm{Fe}}_2{{\left({\mathrm{SO}}_4\right)}_3}_{(\mathrm{aq})}+2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- PbS සමඟ ප්රතික්රියාව
- කළු පැහැති PbS අවක්ෂේපයට H2O2 දමා රත් කලවිට සුදු පැහැති PbSO4 බවට පත්වේ.
\begin{array}{l}{\mathrm{PbS}}_{(\mathrm s)}+4{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\xrightarrow\triangle4{\mathrm H}_2{\mathrm O}_{(\mathrm l)}+{{\mathrm{PbSO}}_4}_{(\mathrm{aq})}\;\\{{\mathrm{SO}}_2}_{(\mathrm g)}+{\mathrm H}_2{{\mathrm O}_2}_{(\mathrm{aq})}\rightarrow{\mathrm H}_2{{\mathrm{SO}}_4}_{(\mathrm{aq})}\end{array}
වැඩිදුර අධ්යනයට ,

