15 කාණ්ඩය (ns2np3)
- N +5 සිට -3 දක්වා ඔක්සිකරණ අවස්ථා පෙන්වයි.
15 කාණ්ඩයේ ඔක්සයිඩ

- P, As, Sb වල ඔක්සයිඩ (Y2O3, Y2O5) සාමාන්යයෙන් ද්වි අවයවික ලෙස පවතී (Y4O6, Y4O10)
- ආම්ලික ඔක්සයිඩ ජලයත් සමඟ ප්රතික්රියාකර ඔක්සො අම්ල සාදයි.
\begin{array}{l}{\mathrm N}_2{\mathrm O}_{5(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;2{\mathrm{HNO}}_{3(\mathrm{aq})\;}\\{\mathrm P}_2{\mathrm O}_{3(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;2{\mathrm H}_3{\mathrm{PO}}_{3(\mathrm{aq})}\end{array}
N – නයිට්රජන් – 1s22s22p3
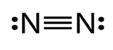
- අවර්ණ නිෂ්ක්රීය වායුවකි.
- ඉතා කෙටි (1.09 A) ත්රිත්ව බන්ධනයක් සහිත නිසා ඉහළ බන්ධන ශක්තියක් (942 kJmol–) ඇත. එම නිසා N2 බන්ධනය විඝටනය කිරීමට ඉතා අසීරු වේ.ඉතා ඉහළ උෂ්ණත්වයකදී පමණක් සක්රීය වී ඔක්සයිඩ සාදයි (අකුණු ගැසීම).
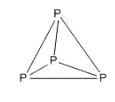
- N ට පහලින් ඇති P ඉහළ සක්රීයතාවක් දක්වයි. ඊට හේතුව P වල ඇති අණුක ව්යුහයයි. වායුගෝලයට විවෘත වූ සැනින් ගිනිගනී. පවතින බන්ධන ශක්තිය N අණුවේ ත්රිත්ව බන්ධන ශක්තියට වඩා බෙහෙවින් අඩු අගයක් ගනී.
- වාතයේ N2 හඳුනා ගැනීමට, Mg පටියක් වාතයේ දහනය කර සෑදෙන කුඩු ජලයට දමා, පිටවන වායුව නෙස්ලර් ප්රතිකාරකයෙන් පෙඟවූ පෙරහන් කඩදාසියකට ඇල්ලු පසු එය කහ දුඹුරු පැහැයට හැරේ.
\begin{array}{l}{\mathrm N}_{2(\mathrm g)}\;+\;3{\mathrm{Mg}}_{(\mathrm s)}\;\rightarrow\;{\mathrm{Mg}}_3{\mathrm N}_{2(\mathrm s)}\;\\{\mathrm{Mg}}_3{\mathrm N}_{2(\mathrm s)}\;+\;6{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\rightarrow\;3\mathrm{Mg}(\mathrm{OH})_{2(\mathrm s)}\;+\;2{\mathrm{NH}}_{3(\mathrm g)}\end{array}
N වල ඔක්සිකරණ තත්ව
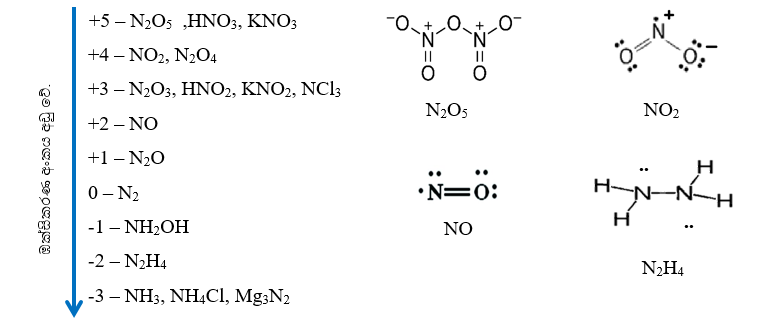
N වල ඔක්සො අම්ල
- ඔක්සො අම්ල 02 කි.
- HNO2
- HNO3
HNO2 – nitric(III) acid – නයිට්රස් අම්ලය
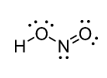
- සිසිල් NaNO2 ද්රාවණයකට තනුක HCl වැනි අම්ලයක් එක් කිරීමෙන් පිළියෙල කර ගත හැක.
{\mathrm{NaNO}}_{2(\mathrm{aq})}\;+\text{ ත}.\;{\mathrm{HCl}}_{(\mathrm{aq})}\;\rightarrow\;{\mathrm{NaCl}}_{(\mathrm{aq})}\;+\;{\mathrm{HNO}}_{2(\mathrm{aq})}
- උෂ්ණත්වය වැඩි වන විට HNO2 වියෝජනය වී , HNO3 හා NO සාදයි.
3{\mathrm{HNO}}_{2(\mathrm{aq})}\;\rightarrow\;{\mathrm{HNO}}_{3(\mathrm{aq})}\;+\;2{\mathrm{NO}}_{(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- මෙම NO වායුව O2 සමඟ තවදුරටත් ප්රතික්රියා කර රතු දුඹුරු පැහැති වායුවක් වන NO2 සාදයි.
2{\mathrm{NO}}_{(\mathrm g)}\;+\;{\mathrm O}_{2(\mathrm g)}\;\rightarrow\;\;2{\mathrm{NO}}_{2(\mathrm g)}
HNO3 – nitric(V) acid – නයිට්රික් අම්ලය
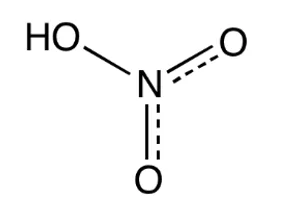
- HNO3 අවර්ණ ද්රාවණයකි.
- KNO3 හෝ NaNO3 වැනි නයිට්රේට ලවණ සා. H2SO4 සමඟ රත් කිරීමෙන් විද්යාගාරයේදී HNO3 අම්ලය සාදා ගත හැක.
{\mathrm{NaNO}}_{3(\mathrm s)}\;+\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm{aq})}\;\rightarrow\;{\mathrm{NaHSO}}_{4(\mathrm{aq})}\;+\;{\mathrm{HNO}}_{3(\mathrm{aq})}
- සාන්ද්ර HNO3 අම්ලය කාමර උෂ්ණත්වයේදී සාමාන්ය කහ පැහැතිවේ. මෙයට හේතුව වන්නේ ආලෝකය ඇති විට HNO3, NO2 හා O2 බවට ද්විධාකරණය වීමයි.
\text{සා.}\;4{\mathrm{HNO}}_{3(\mathrm{aq})}\;\xrightarrow{\mathrm{hv}}\;4{\mathrm{NO}}_{2(\mathrm g)}\;+\;{\mathrm O}_{2(\mathrm g)}\;+\;2{\mathrm H}_{2\mathrm O(\mathrm l)}
- HNO3 ප්රබල අම්ලයකි. HNO2 ට වඩා HNO3 අම්ලය ප්රබල වීමට හේතු දෙකකි.
- HNO2 හි N හි ඔක්සිකරණ අංකය (+3) ට වඩා HNO3 හි N වල ඔක්සිකරණ අංකය (+5) ඉහළ වේ. ඔක්සිකරණ අගය වැඩි වන විට ආම්ලික ප්රබලතාවය වැඩි වේ.
- අම්ලයෙන් H+ අයනයක් නිදහස් වූ විට ලැබෙන NO2¯ ඇනායනයෙහි ස්ථායිතාවයට වඩා NO3¯ ඇනායනයේ ස්ථායිතාවය ඉතා ඉහළ වේ.
- HNO3 වල ආම්ලිකතාවට උදාහරණ,
\begin{array}{l}{\mathrm{HNO}}_{3(\mathrm{aq})}\;+\;{\mathrm{NaOH}}_{(\mathrm{aq})}\;\rightarrow\;{\mathrm{NaNO}}_{3(\mathrm{aq})}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\\2{\mathrm{HNO}}_{3(\mathrm{aq})}\;+\;{\mathrm{CuO}}_{(\mathrm s)}\;\rightarrow\;\mathrm{Cu}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\end{array}
- කාබනික අම්ලයට වඩා ප්රබල හෙයින් CO32¯ හා HCO32¯ සමඟ ප්රතික්රියා කර CO2 මුදා හරියි.
- HNO3 හි ප්රබල ඔක්සිකාරක ගුණය නිසා සාමාන්යයෙන් ලෝහ සමඟ ප්රතික්රියා කර H2 මුදා නොහරියි. ඉතා තනුක HNO3 අම්ල සමඟ පවා ප්රතික්රියා කර H2 මුදා හරින්නේ Mg සහ Mn ලෝහ පමණි.
\begin{array}{l}{\mathrm{Mg}}_{(\mathrm s)}\;+\;\mathrm ත.\;2{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;\mathrm{Mg}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;{\mathrm H}_{2(\mathrm g)}\\{\mathrm{Mn}}_{(\mathrm s)}\;+\;\mathrm ත.\;2{\mathrm{HNO}}_{3(\mathrm{aq})\;}\rightarrow\;\mathrm{Mn}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;{\mathrm H}_{2(\mathrm g)}\end{array}
HNO3 හි ඔක්සිකාරක ගුණය
- HNO3 හි N පරමාණුව එහි උපරිම ඔක්සිකරණ තත්වයේ පවතින බැවින් එය ඔක්සිකාරකයක් ලෙස ක්රියා කර පහළ ඔක්සිකරණ තත්ත්වය ලබා ගනියි (NO2, NO, N2O, NH3). මෙහිදී සෑදෙන ඔක්සිකරණ ඵලය අම්ලයේ සාන්ද්රණය, ලෝහයේ ස්වභාවය හා උෂ්ණත්වය මත රඳා පවතියි.
\begin{array}{l}{\mathrm{Mg}}_{(\mathrm s)}\;+\;\mathrm{සා}.\;4{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;\mathrm{Mg}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;2{\mathrm{NO}}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\\{\mathrm{Cu}}_{(\mathrm s)\;}+\;\mathrm{සා}.\;4{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;\mathrm{Cu}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;2{\mathrm{NO}}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\\3{\mathrm{Cu}}_{(\mathrm s)}\;+\;50\;\%\;\mathrm{සා}.\;8{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;3\mathrm{Cu}({\mathrm{NO}}_3)_{2(\mathrm{aq})}\;+\;2{\mathrm{NO}}_{(\mathrm g)}\;+\;4{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\end{array}
- මෙහිදී Sn භාවිත කලේ නම් ලෝහ ඔක්සයිඩය සෑදී NO2 හා ජලය පිටවේ.
{\mathrm{Sn}}_{(\mathrm s)}\;+\;{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;{\mathrm{SnO}}_{2(\mathrm s)}\;+\;{\mathrm{NO}}_{2(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- HNO3 අලෝහ සමඟ ප්රතික්රියා කළ විට, අලෝහය එහි ඉහළම ඔක්සිකරණ තත්ත්වය වෙත ඔක්සිකරණය වන අතර NO3¯, NO2 බවට ඔක්සිහරණය වේ.
\begin{array}{l}{\mathrm C}_{(\mathrm s)}\;+\;\mathrm{සා}.\;4{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;4{\mathrm{NO}}_{2(\mathrm g)}\-\;+{\mathrm{CO}}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)\;}\\{\mathrm S}_{(\mathrm s)}\;+\;\mathrm{සා}.\;6{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm{aq})}\;+\;6{\mathrm{NO}}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\end{array}
- සංයෝග සාන්ද්ර HNO3 සමඟ රත් කළ විට සංයෝගය ඔක්සිකරණය වන අතර , HNO3 , NO2 බවට ඔක්සිහරණය වේ.
\begin{array}{l}{\mathrm H}_2{\mathrm S}_{(\mathrm g)}\;+\;\mathrm{සා}.\;2{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;2{\mathrm{NO}}_{2(\mathrm g)}\;+\;{\mathrm S}_{(\mathrm s)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\\{\mathrm H}_2{\mathrm S}_{(\mathrm g)}\;+\;\mathrm{සා}.\;8{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;8{\mathrm{NO}}_{2(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm{aq})}\;+\;4{\mathrm H}_2{\mathrm O}_{(\mathrm l)\;}\\2{\mathrm{HI}}_{(\mathrm g)}\;+\;\mathrm{සා}.\;2{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;2{\mathrm{NO}}_{2(\mathrm g)}\;+\;{\mathrm I}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\\\mathrm{Fe}({\mathrm{NO}}_3)_2\;+\;2{\mathrm{HNO}}_{3(\mathrm{aq})}\;\rightarrow\;{\mathrm{NO}}_{2(\mathrm g)}\;+\;\mathrm{Fe}({\mathrm{NO}}_3)_{3(\mathrm{aq})}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\end{array}
NH3 – ඇමෝනියා
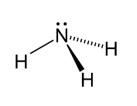
- අවර්ණ , විෂ සහිත කටුක ගන්ධයකින් යුත් භාෂ්මික වායුවකි.
- මෙය ඉතා පහසුවෙන් විශාල ලෙස ජලයේ ද්රාව්ය වේ(H බන්ධන). භාෂ්මික ද්රාවණයක් සාදයි(NH4OH/ ඇමෝනියම් හයිඩ්රොක්සයිඩ්)
- මෙම NH4OH දුබල භෂ්මයක් වන අතර, එය NH4+ හා OH¯ නිපදවමින් භාගික වශයෙන් විඝටනය වේ.
{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}\;\;\leftrightharpoons\;\;{\mathrm{NH}}_4{\mathrm{OH}}_{(\mathrm{aq})}\;\;\leftrightharpoons\;{\mathrm{NH}_4^+}_{(\mathrm{aq})}\;+\;{\mathrm{OH}^-}_{(\mathrm{aq})}
- NH4OH භාෂ්මික ද්රාවණයක් බැවින් තනුක අම්ල සමඟ ප්රතික්රියා කළ ජලීය ලවණ සාදයි.
2{\mathrm{NH}}_4{\mathrm{OH}}_{(\mathrm{aq})}\;+\;\mathrm{dil}.\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm{aq})}\;\rightarrow\;({\mathrm{NH}}_4)_2{\mathrm{SO}}_{4(\mathrm{aq})}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- සියලු ඇමෝනියම් ලවණ ක්ෂාර සමඟ ප්රතික්රියාවෙන් NH3 නිදහස් කරයි.
{\mathrm{NH}}_4{\mathrm{Cl}}_{(\mathrm{aq})}\;+\;{\mathrm{NaOH}}_{(\mathrm{aq})}\;\rightarrow\;{\mathrm{NaCl}}_{(\mathrm{aq})}\;+\;{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- NH3 ඔක්සිකාරකයක්, ඔක්සිහාරකයක්, අම්ලයක්, භෂ්මයක් ලෙස ක්රියා කරයි.
ඔක්සිකාරකයක් ලෙස
- මෙහිදී H හි +1 ඔක්සිකරණ අවස්ථාව 0 ඔක්සිකරණ අවස්ථාව ලබා ගනිමින් H2 නිදහස් කරයි. මෙහිදී Li හා Ⅱ කාණ්ඩයේ මූලද්රව්ය සියල්ලම N3¯ ලවණ (නයිට්රයිඩ) සාදයි. 01 කාණ්ඩයේ අනෙක් ලෝහ NH2¯(ඒමයිඩ) සාදයි.
\begin{array}{l}2{\mathrm{NH}}_{3(\mathrm g)}\;+\;6{\mathrm{Li}}_{(\mathrm s)}\;\rightarrow\;2{\mathrm{Li}}_3{\mathrm N}_{(\mathrm s)}\;+\;3{\mathrm H}_{2(\mathrm g)\;\;}\\2{\mathrm{NH}}_{3(\mathrm g)}\;+\;2{\mathrm{Na}}_{(\mathrm s)}\;\rightarrow\;2{\mathrm{NaNH}}_{2(\mathrm S)}\;+\;{\mathrm H}_{2(\mathrm g)}\;\;\\2{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{Mg}}_{(\mathrm s)}\;\rightarrow\;{\mathrm{Mg}}_3{\mathrm N}_{2(\mathrm s)}\;+\;3{\mathrm H}_{2(\mathrm g)}\end{array}
ඔක්සිහාරකයක් ලෙස
- මෙහිදී NH3 හි N ගේ -3 ඔක්සිකරණ තත්ත්වය ඉහළ ඔක්සිකරණ තත්ත්වයක් ලබා ගැනේ.
4{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm O}_{2(\mathrm g)}\;\rightarrow\;2{\mathrm N}_{2(\mathrm g)}\;+\;6{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- රත් කළ CuO මතුපිටින් NH3 වායුව යැවූ විට Cu ,නිදහස් N2 හා ජල වාෂ්ප පිට කරයි.
2{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{CuO}}_{(\mathrm s)}\;\rightarrow\;3{\mathrm{Cu}}_{(\mathrm s)}\;+\;{\mathrm N}_{2(\mathrm g)}\;+\;3{\mathrm H}_2{\mathrm O}_{(\mathrm l)}
- NH3, Cl2 සමඟ තුන්විදියකට ප්රතික්රියා කරයි. සාමාන්ය තත්වයේදී.
2{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{Cl}}_{2(\mathrm g)}\;\rightarrow\;{\mathrm N}_{2(\mathrm g)}\;+\;6{\mathrm{HCl}}_{(\mathrm g)}
- මෙම ප්රතික්රියාවේ දී NH3 වැඩිපුර ඇති විට, ඇති HCl , NH3 සමඟ තවදුරටත් ප්රතික්රියා කර NH4Cl ඝන සුදු දුමාරය සාදයි.
8{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{HCl}}_{(\mathrm g)}\;\rightarrow\;6{\mathrm{NH}}_4{\mathrm{Cl}}_{(\mathrm s)}\;+\;{\mathrm N}_{2(\mathrm g)}
- මෙම ප්රතික්රියාවේ දී Cl2 වැඩිපුර ඇති විට NCl3 දක්වා තවදුරටත් ඔක්සිකරණය වේ.
{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{Cl}}_{2(\mathrm g)}\;\rightarrow\;{\mathrm{NCl}}_{3(\mathrm g)}\;+\;3{\mathrm{HCl}}_{(\mathrm g)}
අම්ලයක් ලෙස
- NH3 වායුව හෝ ද්රව්ය සක්රීය ලෝහ සමඟ ප්රතික්රියා කර H2 පිට කිරීම ආම්ලිකතාවයට උදාහරණයක් වේ.
\begin{array}{l}\;2{\mathrm{NH}}_{3(\mathrm g)}\;+\;6{\mathrm{Li}}_{(\mathrm s)}\;\;\xrightarrow{\mathrm\Delta}2{\mathrm{Li}}_3{\mathrm N}_{(\mathrm s)}\;+\;3{\mathrm H}_{2(\mathrm g)}\;\;\\2{\mathrm{NH}}_{3(\mathrm g)}\;+\;2{\mathrm{Na}}_{(\mathrm s)}\;\xrightarrow{\mathrm\Delta}2{\mathrm{NaNH}}_{2(\mathrm s)}\;+\;{\mathrm H}_{2(\mathrm g)}\;\;\\2{\mathrm{NH}}_{3(\mathrm g)}\;+\;3{\mathrm{Mg}}_{(\mathrm s)}\;\xrightarrow{\mathrm\Delta}{\mathrm{Mg}}_3{\mathrm N}_{2(\mathrm s)}\;+\;3{\mathrm H}_{2(\mathrm g)}\end{array}
භෂ්මයක් ලෙස
- NH3 ද්රව හෝ ජලීය අවස්ථාව අම්ල සමඟ ප්රතික්රියාවෙන් ලවණ සාදයි.
\begin{array}{l}{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm{HCl}}_{(\mathrm g)}\;\rightarrow\;{\mathrm{NH}}_4{\mathrm{Cl}}_{(\mathrm s)}\;\\2{\mathrm{NH}}_{3(\mathrm{aq})}\;+\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm{aq})}\;\rightarrow\;({\mathrm{NH}}_4)_2{\mathrm{SO}}_{4(\mathrm{aq})}\end{array}
ඇමෝනියම් ලවණ
- ලවණයක් යනු භාෂ්මික ප්රභේදයෙන් ලැබෙන කැටායනය හා ආම්ලික ප්රභේදයෙන් ලැබෙන ඇනායනය එක්වීමෙන් සාදන අයනික සංයෝග විශේෂයකි.
- NH3, අම්ල සමඟ ප්රතික්රියාවෙන් ඇමෝනියම් ලවණ නිර්මාණය වේ.
- NH4NO3, NH4NO2, (NH4)2Cr2O7 යන ඇමෝනියම් ලවණ රත් කිරීමේදී ඇමෝනියම් අයනය ඔක්සිකරණය වේ.
\begin{array}{l}{\mathrm{NH}}_4{\mathrm{NO}}_{3(\mathrm s)}\xrightarrow\bigtriangleup\;{\mathrm N}_2{\mathrm O}_{(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\;\\{\mathrm{NH}}_4{\mathrm{NO}}_{2(\mathrm s)}\;\xrightarrow\bigtriangleup\;{\mathrm N}_{2(\mathrm g)}\;+\;2{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\;\\({\mathrm{NH}}_4)_2{\mathrm{Cr}}_2{\mathrm O}_{7(\mathrm s)}\;\xrightarrow\bigtriangleup\;{\mathrm N}_{2(\mathrm g)}\;+\;{\mathrm{Cr}}_2{\mathrm O}_{3(\mathrm s)}\;+\;4{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\end{array}
අනෙක් ඇමෝනියම් ලවණ වියෝජනය වී NH3 හා අම්ලය සාදයි.
\begin{array}{l}{\mathrm{NH}}_4{\mathrm{Cl}}_{(\mathrm s)}\;\xrightarrow{\mathrm\Delta}\;{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm{HCl}}_{(\mathrm g)}\;\;\;\\({\mathrm{NH}}_4)_2{\mathrm{SO}}_{4(\mathrm s)}\;\xrightarrow{\mathrm\Delta}\;2{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm{SO}}_{4(\mathrm g)}\;\;\\{\mathrm{NH}}_4{\mathrm I}_{(\mathrm s)}\xrightarrow{\mathrm\Delta}\;{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm{HI}}_{(\mathrm g)}\;-------------\;2{\mathrm{HI}}_{(\mathrm g)}\;\rightarrow\;{\mathrm H}_{2(\mathrm g)}\;+\;{\mathrm I}_{2(\mathrm g)}\;\;\\({\mathrm{NH}}_4)_2{\mathrm{CO}}_{3(\mathrm s)\;}\xrightarrow{\mathrm\Delta}\;{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm{CO}}_{2(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\;\;\\({\mathrm{NH}}_4)_2{\mathrm C}_2{\mathrm O}_{4(\mathrm s)}\;\xrightarrow{\mathrm\Delta}\;{\mathrm{NH}}_{3(\mathrm g)}\;+\;{\mathrm{CO}}_{(\mathrm g)}\;+\;{\mathrm{CO}}_{2(\mathrm g)}\;+\;{\mathrm H}_2{\mathrm O}_{(\mathrm g)}\end{array}

