සංයුක්ත වායු නියමය
- වායු ප්රමාණය මවුලවලින් මැන්න විට සියලු වායු, පීඩනය, පරිමාව හා උෂ්ණත්වයට අනුබද්ධව එකම ආකාරයකට හැසිරේ.
- නිත්ය වායු ප්රමාණයක උෂ්ණත්වය, පීඩනය හා පරිමාව යන රාශීන් T1, P1, V1 සිට T2, P2, V2 දක්වා වෙනස් කරන විට, පරිපූර්ණ වායු සමීකරණය අනුපාතයක් ලෙස ලිවිය හැකිය.
මෙය සංයුක්ත වායු නියමය ලෙස හැඳින්වේ.
නිදසුන 1
25^0\mathrm C දී සහ පීඩනයකදී දෙන ලද වායු ප්රමාණයක පරිමාව 600 cm3 වේ. 10^0\mathrm C දී එහි පරිමාව 650 cm3 වන විට එහි පීඩනය කුමක් වේද?
(T1, P1, V1) සිට (T2, P2, V2) දක්වා අපට ලිවිය හැකිය.
\begin{array}{rcl}\frac{{\mathrm P}_1\;{\mathrm V}_1}{{\mathrm T}_{1\;}}\;&=&\;\frac{{\mathrm P}_2\;{\mathrm V}_2}{{\mathrm T}_2}\\&&\\\frac{760\;\mathrm{mmHg}\;\times\;600\;\mathrm{cm}^3}{298\;\mathrm K}\;&=&\frac{{\mathrm P}_{2\;}\times650\mathrm{cm}^3}{283\;\mathrm K}\\&&\\\;{\mathrm P}_{2\;}\;&=&\;666.2\;\mathrm{mmHg}\;=\;88823\;\mathrm{Pa}\;=\;88.823\;\mathrm{kPa}\end{array}
ඩෝල්ටන් ගේ ආංශික පීඩන නියමය
- කිසියම් පරිපූර්ණ වායුවක් බඳුනක හුදෙකලාව පවතින විට එම වායුවේ පීඩනය,එම වායු ප්රමාණයම එම පරිමාව සහිත බදුනක් තුළ එම උෂ්ණත්වයේ දීම වායු මිශ්රනයකදී ඇති කරන පීඩනයට සමාන වේ. මේ අනුව වායු මිශ්රනයකදී කිසියම් වායුවක් විසින් ඇති කරන පීඩනය එම වායුවේ ආංශික පීඩනයයි.
- පරිපූර්ණ වායු සංඝටක කීපයක් අඩංගු වායු මිශ්රණයක මුළු පීඩනය, අඩංගු එක් එක් වායු සංඝටකවල ආංශික පීඩනයන්ගේ මුළු එකතුවට සමාන වේ යන්න ඩෝල්ටන්ගේ ආංශික පීඩන නියමයයි.
එනම් A, B සහ C යන පරිපූර්ණ වායූන් අඩංගු මිශ්රණයක A හි ආංශික පීඩනය PA ද, B හි ආංශික පීඩනය PB ද, C හි ආංශික පීඩනය PC ද, එම වායූන් අඩංගු මුළු වායු මිශ්රණයේ මුළු පීඩනය PT ද වේ නම්;
ඩෝල්ටන්ගේ ආංශික පීඩන නියමය පරිපූර්ණ වායු සමීකරණය භාවිතයෙන් ගොඩනැඟිය හැකිය.
T උෂ්ණත්වයේ දී V පරිමාවක් තුළ A හා B නම් වායූන් අඩංගු මිශ්රණයක් සලකමු. එහි A හි මවුල ප්රමාණය nA ද, B හි මවුල ප්රමාණය nB ද, මුළු මවුල ප්රමාණය nT ද, A හි ආංශික පීඩනය PA ද, B හි ආංශික පීඩනය PB ද, මුළු පීඩනය PT ද යැයි සලකමු.
A වායුව සලකා,
B වායුව සලකා,
මුළු පද්ධතිය සලකා,
- ඩෝල්ටන්ගේ ආංශික පීඩන නියමයේ විකල්ප ආකාරය
T උෂ්ණත්වයේ දී V පරිමාවක් තුළ A හා B නම් වායූන් අඩංගු මිශ්රණයක් සලකමු. එහි A හි මවුල ප්රමාණය nA ද, B හි මවුල ප්රමාණය nB ද, මුළු මවුල ප්රමාණය nT ද, A හි ආංශික පීඩනය PA ද, B හි ආංශික පීඩනය PB ද, මුළු පීඩනය PT ද යැයි සලකමු.
A වායුව සලකා,
B වායුව සලකා,
ඩෝල්ටන්ගේ නියමය අනුව;
1 / 3 මඟින්,
\begin{array}{rcl}\frac{{\mathrm P}_{\mathrm A}}{{\mathrm P}_{\mathrm T}}\;&=&\;{\mathrm X}_{\mathrm A}\\&&\\{\mathrm P}_{\mathrm A}\;&=&\;{\mathrm X}_{\mathrm A}{\mathrm P}_{\mathrm T}\end{array}
2 / 3 මඟින්,
ඒ අනුව,
ආංශික පීඩනය = මුළු පීඩනය × මවුල භාගය
මේ අනුව ඩෝල්ටන්ගේ ආංශික පීඩන නියමයේ විකල්ප ආකාරයෙන් කියවෙන්නේ කිසියම් උෂ්ණත්වයකදී එකිනෙක ප්රතික්රියා නොකරන පරිපූර්ණ වායු අඩංගු මිශ්රනයක යම් සංඝටකයක ආංශික පීඩනය, මුළු පීඩනයේත්, මිශ්රනය තුළ එම සංඝටකයේ මවුල භාගයේත් ගුණිතයට සමාන වන බවයි.
නිදසුන 2
- වායු මිශ්රණයක නයිට්රජන් වායුව 0.8mol ද ඔක්සිජන් වායුව 0.2mol ද අඩංගු විය. එක්තරා උෂ්ණත්වයක දී වායු මිශ්රණයේ පීඩනය 1atm නම්, එක් එක් වායුවේ ආංශික පීඩනය ගණනය කරන්න.
- බඳුන රත්කර නියත උෂ්ණත්වයක පවත්වා ගත් විට N2 වායුව O2 වායු සමඟ ප්රතික්රියා කර NO2 වායුව සාදයි. සමතුලිතතාවයේ දී බඳුනෙහි N2 වායු මවුල 0.7ක් ද, O2 වායු මවුල 0. 15 ක් ද, NO2 වායු මවුල 0.1ද ඇත. එවිට වායුවේ ආංශික පීඩනය 0. 88atm නම් O2 හා NO2 වායුවල ආංශික පීඩනය ගණනය කරන්න.
විසඳුම
\begin{array}{rcl}&&{\mathrm O}_2\;;\\\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\mathrm P}_{\mathrm T}\;\;&=&\;{\mathrm P}_{{\mathrm O}_2}\;+\;\;{\mathrm P}_{{\mathrm N}_2}\\1\;\mathrm{atm}\;&=&\;{\mathrm P}_{{\mathrm O}_2}\;+0.8\;\mathrm{atm}\\\;{\mathrm P}_{{\mathrm O}_2}&=&0.2\;\mathrm{atm}\end{array}
\begin{array}{l}\;\;\;\;{\mathrm X}_{{\mathrm O}_2\;\;}\;=\;\;\frac{{\mathrm n}_{{\mathrm O}_2}}{{\mathrm n}_{{\mathrm N}_2}\;+\;\;{\mathrm n}_{{\mathrm O}_2}\;+\;{\mathrm n}_{{\mathrm{NO}}_2}}\\\\\;\;\;\;{\mathrm X}_{{\mathrm O}_2\;\;}\;=\;\frac{0.15\;\mathrm{mol}}{0.7\;\mathrm{mol}\;+0.15\;\mathrm{mol}\;+\;0.1\;\mathrm{mol}}\;=\frac{0.15}{0.95}\\\\\;\;\;\;\;{\mathrm P}_{{\mathrm O}_2}\;\;=\;\;{\mathrm X}_{{\mathrm O}_2}\;{\mathrm P}_{\mathrm T}\;\;\;\\\\\therefore\;\;{\mathrm P}_{{\mathrm O}_2}\;=\;\frac{0.15}{0.95}\;\times\;1.19\;\mathrm{atm}\;\;=\;\;0.19\;\mathrm{atm}\\\end{array}
\begin{array}{l}\\\;\;\;\;\;{\mathrm X}_{{\mathrm{NO}}_2\;\;}\;=\;\;\frac{{\mathrm n}_{{\mathrm{NO}}_2}}{{\mathrm n}_{{\mathrm N}_2}\;+\;\;{\mathrm n}_{{\mathrm O}_2}\;+\;{\mathrm n}_{{\mathrm{NO}}_2}}\\\;\;\\\;\;\;\;\;{\mathrm X}_{{\mathrm{NO}}_2\;\;}\;=\;\frac{0.1\;\mathrm{mol}}{0.7\;\mathrm{mol}\;+\;0.15\;\mathrm{mol}\;+\;0.1\;\mathrm{mol}}\;=\;\frac{0.1}{0.95}\\\\\\\therefore\;\;{\mathrm P}_{{\mathrm{NO}}_2}\;=\;\frac{0.1}{0.95}\;\times\;1.19\;\mathrm{atm}\;\;=\;\;0.12\;\mathrm{atm}\\\\\;\;\;\;\;\;\;\;{\mathrm P}_{{\mathrm N}_{2_{}}}\;=\;0.88\;\mathrm{atm}\\\\\;\;\;\;\;\;\;\;{\mathrm P}_{{\mathrm O}_2}\;\;=\;0.19\;\mathrm{atm}\\\\\;\;\;\;\;\;\;{\mathrm P}_{{\mathrm{NO}}_2}\;=\;0.12\;\mathrm{atm}\\\\\;\;\;\;\;\;\;\;\;\;\;{\mathrm P}_{\mathrm T\;}\;=\;1.19\;\mathrm{atm}\end{array}
නිදසුන 3
පහත ප්රතික්රියාවට අනුව KClO3 රත් කිරීමෙන් ඔක්සිජන් වායුව පිළියෙල කරන්නේ යැයි සිතන්න.
27℃ සහ 760 torr හි දී O2 වායුව 1.50 d ක් ජලය හරහා එකතු කරනු ලැබේ. 27℃ දී ජලයේ සංතෘප්ත වාෂ්ප පීඩනය 26.7 torr වේ. සෑදුණු වායු මවුල ප්රමාණය ගණන කරන්න.
විසඳුම :
ඩෝල්ටන්ගේ නියමයට අනුව,
පරිපූර්ණ වායු සමීකරණය යෙදීමෙන් ,
අන්තර්ගතය : ඩෝල්ටන්ගේ ආංශික පීඩන නියමය ආශ්රිත ගැටලු
අන්තර්ගතය : පරිපූර්ණ වායු සමීකරණය මගින් වායු නියම ඔප්පු කිරීම
ප්රායෝගික පරීක්ෂණය මැග්නීසියම් වල සාපේක්ෂ පරමාණුක ස්කන්ධය පරීක්ෂණාත්මකව නිර්ණය කිරීම
අරමුණ
ලෝහවල සාපේක්ෂ පරමාණුක ස්කන්ධය නිර්ණය කිරීම් සඳහා අවශ්ය වන කුසලතාව.
පෙර පරීක්ෂණ ප්රශ්න
- ජලය සමඟ ප්රතික්රියා නොකරන විවිධ වායු ලැයිස්තු ගතකරන්න.
- තනුක අම්ල සමඟ වේගයෙන් ප්රතික්රියා කරන ලෝහ ලැයිස්තු ගත කර ඒවා සඳහා තුලිත රසායනික සමීකරණය ලියන්න.
- පරිපූර්ණ වායු නියමය සහ ආංශික පීඩනය පිළිබඳ ඩෝල්ටන්ගේ නියමය ප්රකාශ කරන්න. සියලු පද අර්ථ දක්වන්න.
- විද්යාගාරයේ දී වායු එක්රැස් කර ගැනීමට භාවිතා කරන විවිධ ක්රමවේද ලැයිස්තුගත කරන්න.
හැඳින්වීම
වායුමය ප්රතික්රියා සඳහා වායු පරිමා මිනුම් ඒවායෙහි ස්ටොයිකියෝමිතිය සම්බන්ධතා නිර්ණය කිරීම සඳහා පහසුකම් ලබා දේ. සමහර ලෝහ අම්ල සමග ප්රතික්රියා කර හයිඩ්රජන් වායුව නිදහස් කරයි. මේ පරීක්ෂණයේදී මැග්නීසියම් තනුක HCl සමග ප්රතික්රියාවෙන් සෑදෙන හයිඩ්රජන් වායු ප්රමාණය, Mg හි සාපේක්ෂ පරමාණුක ස්කන්ධය ගණනය කිරීමට භාවිතා කෙරේ.
මේ ප්රතික්රියාවේ දී නිපදවන හයිඩ්රජන් වායුව ජලයේ යටිකුරු විස්ථාපනයෙන් වායු පරිමාමානය නමින් හඳුන්වනු ලබන දිග, සිහින් ක්රමාංකනය කරන ලද වීදුරු නළයකට හෝ බියුරෙට්ටුවකට එකතු කරගනු ලැබේ. අම්ල සමග ප්රතික්රියා කරන විට ජලයේ විස්ථාපනයෙන් එකතු කර ගන්නා ලද පරිමාව මැන ගනු ලැබේ. වායුවේ උෂ්ණත්වය ඒ හා සම්බන්ධව පවත්නා ජලයේ උෂ්ණත්වය සමාන ලෙස සලකනු ලබන්නේ දෙන ලද ප්රමාණවත් කාලයක් තුලදී ජලය හා වායුව යන දෙකම තාපමය වශයෙන් සමතුලිතතාවට එළැඹීම නිසාය. වායු පරිමාමානයේ ජල මට්ටම පිටත ජල මට්ටමට සමාන වන සේ සකසනු ලැබේ. මෙමගින් වායු පරිමාමානයේ පීඩනය පවතින වායුගෝලීය පීඩනයට සමාන වන බව තහවුරු කරගත හැකිය. වායුව ජල මට්ටමට උඩින් එකතු කරන බැවින්, ජලයට විශේෂිත වූ වාෂ්ප පීඩනයක් පවතින අතර පිරිසිදු වල(වියලි වල )පීඩනය ලබා ගැනීමට නම් ජලයේ වාෂ්ප පීඩනය අඩුකළ යුතුය.
වියළි ඔක්සිජන් වායුවේ පීඩනය ආංශික පීඩනය පිළිබඳ ඩෝල්ටන් නියමයෙන් ගණනය කළ හැකිය.
මෙහි යනු වායුගෝලීය පීඩනයද යනු ජලයේ වාෂ්ප පීඩනය ද වේ.
එක් එක් උෂ්ණත්වයට අදාළ වන ජලයේ වාෂ්ප පීඩනය පහත වගුවට අනුව ලබාගත හැකිය
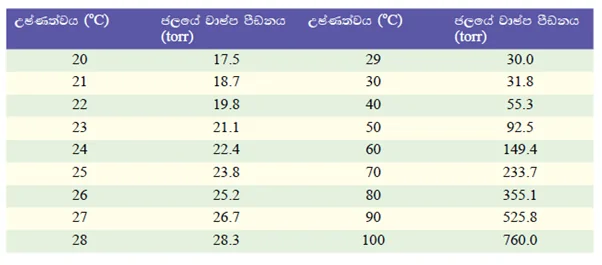
H2 වායුවේ පරිමාව (V) දන්නා බැවින් එකතු කරන ලද H2 වායු මවුල ගණන පරිපූර්ණ වායු නියමය ඇසුරෙන් ගණනය කළ හැකිය.
Mg හා H2 වායුව අතර ස්ටොයිකියෝමිතිය 1:1 අනුපාතය බැවින්, HCl සමග ප්රතික්රියා කරන ලද Mg මවුල ප්රමාණය ගණනය කළ හැකිය . ප්රතික්රියා කරන ලද මැග්නීසියම් පටියේ ස්කන්ධය දන්නා බැවින් පහත ආකාරයට මැග්නීසියම් වල සාපේක්ෂ පරමාණුක ස්කන්ධය ගණනය කළ හැකිය.
අවශ්ය උපකරණ හා රසායනාගාර ද්රව්ය
උපකරණ
- වායුපරිමාමානය
- 1L බීකරය
- බියුරෙට්ටු අඬු
- බියුරෙට්ටු ආධාරක
- උෂ්ණත්වමානය
- බැරෝමීටරය
රසායන ද්රව්ය
- මැග්නීසියම් පටි
- Cu කම්බි කැබැල්ලක්
- 2M HCl
පරීක්ෂණ ඇටවුම
පහත පරීක්ෂණ ඇටවුම භාවිතයෙන් ජලයේ යටිකුරු විස්ථාපනයෙන් වායුව එක් රැස් කර ගනු ලැබේ. වායුපරිමාමාන වෙනුවට යටිකුරු කරන ලද බියුරෙට්ටුවක් වුවද භාවිතා කළ හැකිය.

ආරක්ෂිත පියවර: අම්ල භාවිතයේදී අත්වැසුම් පළඳින්න
ක්රමය
- 10cm3 ක්රමාංකිත සිලින්ඩරයකට 2 moldm-3 HCl ද්රවණයෙන් 5cm3 ඉවත් කර ගනු ලැබේ.
- එම HCl මතට පරිස්සමින් ජලය එක්කර ගනිමින් (ජලය හා HCl මිශ්ර නොවන සේ) සිලින්ඩරය සම්පූර්ණයෙන් ජලයෙන් පුරවා ගන්න.
- 1cm මැග්නීසියම් පටියක් ඇබයේ කෙළවරට සම්බන්ධ කර. ඇබය ක්රමාංකිත සිලින්ඩරය මත සවිකර ගන්න.
- සිලින්ඩරය ක්ෂණිකව යටිකුරු කර එහි පහළ කොටස ජලය පුරවා ගත් 1L වන ජලය සහිත බීකරයක ගිල්වන්න.
- HCl , ලෝහය සමග ප්රතික්රියා කරමින් යටිකුරු කරන ලද සිලින්ඩරය තුළට වායුව එකතු වීම සිදුවන අතර ප්රතික්රියාව අවසන් වූ පසු සිලින්ඩරය තුල සහ බීකරය තුළ ජල මට්ටම් සමානකර වායුවේ පරිමාව නිර්ණය කරගනු ලැබේ. මෙම පරීක්ෂණය තෙවතාවක් සිදුකරන්න.
ප්රතිඵල
| 01 පරීක්ෂණය | 02 පරීක්ෂණය | 03 පරීක්ෂණය | සාමාන්ය අගය | |
| Mg වල ස්කන්ධය(g) | ||||
| නිපදවූ H2වායුවේ පරිමාව(cm3) | ||||
| උෂ්ණත්වය({}^0\mathrm C) | ||||
| H2Oවල ආංශික පීඩනය (Hgmm) |
ගණනය කිරීම
01. වියළි H2වායුවේ පීඩනය (P_{H_2}) , මුළු පීඩනයෙන් (P_\text{සමස්ත}) ජලයේ වාෂ්ප පීඩනය (P_{H_2O}) අඩු කිරීමෙන් ගණනය කර ගත හැක.
{\mathrm P}_{\mathrm{සමස්ත}\;\;} සමස්ත (වායුපරිමාමාන පීඩනය) යනු වායුගෝලීය පීඩනය වන අතර {\mathrm P}_{{\mathrm H}_2\mathrm O\;} යනු කාමර උෂ්ණත්වයේ දී ජලයේ වාෂ්ප පීඩනය වේ. ජලයේ වාෂ්ප පීඩනය සොයා ගැනීමට දී ඇති වගුව භාවිතා කරන්න.
{\mathrm P}_{{\mathrm H}_2}\text{ }=\;............................\;\mathrm{mmHg}
02. මේ පීඩනය mmHg සිට Nm-2වලට පරිවර්තනය කරන්න.
(760.0 Hgmm =1.01 × 105 Nm-2)
03. පරීක්ෂණයේදී නිපදවාගත් H2 වායුවේ මවුල ගණන ගණනය කිරීමට පරිපූර්ණ වායු සමීකරණය යොදාගන්න.
04. අනතුරුව හා වල ස්ටොයිකියෝමිතිය භාවිතයෙන් වල මවුල ගණන ගණනය කර Mgවල සාපේක්ෂ පරමාණුක ස්කන්ධය ගණනය කරන්න.
සාකච්ඡාව
- දෝෂ ඇතිවිය හැකි ආකාර ගැන සහ සාකච්ඡා කරන්න.
- ගණනය කරන ලද අගය සම්මත අගය හා සංසන්දනය කර දෝෂ ප්රතිශතය ගණනය කරන්න.
පසු පරීක්ෂණ ප්රශ්න
- මේ පරීක්ෂණයේ දී යොදා ගත හැකි ලෝහවල නම් ලැයිස්තු ගත කරන්න.
- තඹ කම්බිය හයිඩ්ර්ජන් වායුව නිපදවන ප්රමාණය කෙරෙහි බලපායි ද?හේතු දක්වන්න.
- පිත්තල කැබැල්ලක අඩංගු Cu හා Zn ප්රතිශතය ගණනය කිරීමට මෙම පරීක්ෂණාත්මක ඇටවුම භාවිතා කළ හැකිද?

