හයිඩ්රොකාබන යනු,
කාබන් හා හයිඩ්රජන් පමණක් අඩංගු සංයෝග වේ.
- ඇල්කේන
- ඇල්කීන
- ඇල්කයින
- බෙන්සීන්
ඇලිෆැටික හයිඩ්රොකාබන වල භෞතික ගුණ හා බන්ධන ස්වාභාවය පිළිබදව විමසා බලමු.
ඇල්කේන
- ඇල්කේන යනු සංතෘප්ත හයිඩ්රොකාබනයකි.එනම් ඒවා කාබන්- කාබන් (C-C) තනි බන්ධන පමණක් ඇති ඒවායි.
- මෙහිදී සරලම ඇල්කේනය ලෙස CH4 (මෙතේන්) දැක්විය හැකි අතර එහි කාබන් පරමාණුවට හයිඩ්රජන් පරමාණු 4ක් බැදී ඇත.
- කාබන් 2ක් සම්බන්ධ ඇල්කේනය CH3CH3 (එතේන්) වේ.
- අනිවාර්යය ලෙස C පරමණුවකට බන්ධන 4ක් පැවතිය යුතුය.
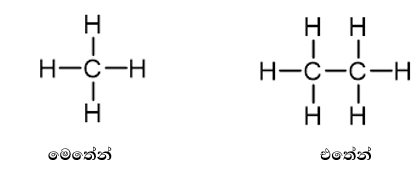
- ඇලිෆැටික ඇල්කේනවල පොදු සූත්රයක් පවතින් අතර එය CnH2n+2 ( මෙහි n=1,2,3..)
දැන් ඇල්කේන වල භෞතික ගුණ ගැන සලකා බලමු.
ද්රවාංක හා තාපාංක
- ඇල්කේන නිර්ධ්රැවීය හෝ ඉතා දුබල ලෙස ධ්රැවීය වේ.එනම් ඒවායේ පවතින්නේ දුබල අපකිරණ බලයි.
**පෘෂ්ඨ වර්ගඵලය වැඩි වන විට අපකිරණ බල වල ප්රබලතාව වැඩි වේ
**පෘෂ්ඨ වර්ගඵලය ↑ ⇒ අපකිරණ බල ප්රබලතාව↑
එමනිසා ද්රවාංක හා තාපාංක ->
CH4 < CH3CH3 < CH3CH2CH3
කාමර උෂ්ණත්වයේදී,
C1 සිට C4 දක්වා -> වායු
C5 සිට C 18 දක්වා -> ද්රව
C 18 ට වැඩි -> ඝන
- නමුත් එකම අණුක සූත්රයක් සදහා අංශදාම ගණන වැඩි වන විට ද්රවාංක තාපාංක අඩු වේ.
උදා:-

ජල ද්රාව්යතාව
- ඇල්කේන නිර්ධ්රැවීය වේ.
- එමනිසා ජලයේ දිය නොවේ.
ඇල්කේන වල ව්යුහය සෑදෙන්නේ කෙසේද?
- සරලම ඇල්කේනය වන මෙතේන් (CH4 )සලකමු.
- කාබන් පරමාණුව H පරමාණු 4ක් සමග සහසංයුජව බන්ධන 4ක් සාදා ගනී.
- P කාක්ෂික 2ක් පමණක් පවතින බැවින් එයට සාදා ගත හැක්කේ එකිනෙකට ලම්භක බන්ධන 2ක් පමණි.
C- 1s2 2s2 2p2
- 2s කාක්ෂිකයේ ඇති ඉලෙක්ට්රෝන 2 වියුග්ම වී එකක් p කාක්ෂිකය දක්වා ඉහලට ගිය හොත් C පරමාණුවට එක් ඉලෙක්ට්රොනය බැගින් වන කාක්ෂික 4ක් සාදා ගත හැක.
- මෙතෙන් අණුවේ ඇති එක සමාන C-H බන්ධන 4 පැහැදිලි කිරීම සදහා 2p හා 2s කාක්ෂික මිශ්ර වේ යැයි සලකනු ලැබේ.
- මිශ්ර වීමෙන් නව කාක්ෂික සෑදීම මුහුම්කරණය යැයි අපි දනිමු.
- මෙතේන් වල කාබන් මුහුම් කාක්ෂික 4 sp3 වන අතර එය සෑදීමට s කාක්ෂිකයක් හා p කාක්ෂික 3ක් මිශ්ර විය යුතුය.මෙවැනි C පරමාණු sp3 මුහුම්කරණය වී ඇතැයි සැල්කේ.
- එය ප්රස්තාරිකව,

- ඒ අනුව චතුස්තලීය ආකාරයට සැකසෙන කාක්ෂික 4ක් පවතී.

ඇල්කේන වල රසායනික ප්රතික්රියා.
- ඇල්කේන නිර්ධ්රැවීය බැවින් ඉතා ඉහල ඍණ හෝ අධික ධන වන පරමාණු වලින් සමන්විත නොවේ.
- එමනිසා OH–,CN–,H+වැනි සුලබ ධ්රැවීය ප්රතිකාරක සමග සාමන්ය තත්ව යටතේ ප්රතික්රියා නොවේ.
පළමුව ඇල්කේන සාදා ගන්නා ආකාරය බලමු.
1. ඇල්කීන උත්ප්රේරිත හයිඩ්රජනීකරණය මගින්
- මෙහිදී උත්ප්රේරකයක් ලෙස Ni හෝ Pd හෝ Pt ඇති විට ඇල්කීන H2 සමග ප්රතික්රියා කර අනුරූප ඇල්කේනය සාදයි.
- මෙහිදී ඇල්කේනය 300 °C කට පමණ ආසන්න උෂ්ණත්වයකදී Ni,Pt,Pd වැනි උත්ප්රේරක H2 සමඟ රත් කිරීමෙන් ඒවායේ ඇති C- C \mathrm\pi බන්ධන හයිඩ්රජනීකණය වී ඇල්කේන නිපදවයි.
2. ඇල්කයින උත්ප්රෙරිත හයිඩ්රජනීකරන්යෙන්
3. ඇල්ඩිහයිඩ කීටෝන ක්ලෙමෙන්සන් ඔක්සිහරණයෙන්
- මෙහිදී කාබනිල් O පරමාණුව වෙනුවට H පරමාණු 2 ක් සම්බන්ධ වේ.

4. ග්රීනාඩ් ප්රතිකාරකයට ජලය එක් කිරීමෙන්
- තමා වටා පවතින අධික ඉලෙක්ට්රෝන ඝනත්වය නිසා Mg බැදුණු C පරමාණුව H2O හා තනුක අම්ල හමුවේ භෂ්මයක් ලෙස ක්රියා කරයි.
5. ග්රීනාඩ් ප්රතිකාරකය හා ඇල්කිල් හේලයිඩ අතර ප්රතික්රියාවෙන්,
දැන් ඇල්කේන මගින් කල හැකි ප්රතික්රියා මොනවාද?
- මෙහිදී ඇල්කේන හැලජන සමග ප්රතික්රියාව පමණක් සලකනු ලැබේ.
CH4 හා Cl2 අතර ප්රතික්රියාව සලකමු. (මෙතේන් ක්ලෝරිනීකරණය)
- පාරජම්බූල කිරණ හමුවේ Cl2 අණු සමවිච්ඡේදනය වී \frac\circ{\text{Cl}} මුක්තඛණ්ඩක සෑදේ.
- එය CH4 සමග ප්රතික්රියා කර CH3Cl , CH2Cl2 , CHCl3 , CCl4 මිශ්රණයක් සෑදේ.
- මෙම යාන්ත්රණය පියවර 3කින් සමන්විතයි.
- දාම ආරම්භක පියවර
- දාම ප්රචාරණ පියවර
- දාම අවසන් පියවර
- දාම ආරම්භක පියවර
CH4 හා Cl2 අඩංගු මිශ්රණයකට විසරිත හිරු එලිය වැටීමට සැලැස්වූ විට Cl2 පහත ලෙස සමවිච්ඡේදනය වේ.

- දාම ප්රචාරණ පියවර
ඉහතින් සෑදෙන Cl. මුක්තඛණ්ඩක CH4 මත පහත ලෙස ප්රතික්රියා වේ.

ඉන්පසු පහත පටිපාටියට අනුව සිදුවේ.
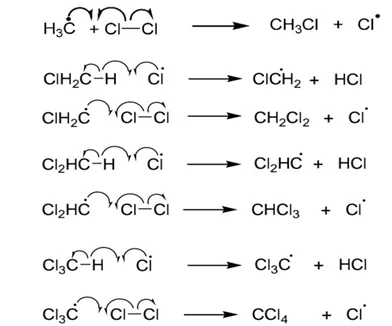
මෙම දාමය අවසන් වනුයේ දාම අවසාන ප්රතික්රියා වලිනි.
- දාම අවසන් පියවර
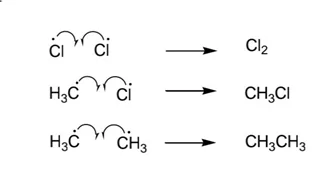
එමනිසා ප්රතික්රියාවේදී ඵල මිශ්රණයක් සෑදෙන බව නිරීක්ෂණය කිරීමට පුළුවන.
- මෙහිදී භාවිතා කරන හැලජනය මත ප්රතික්රියාවේ ශීඝ්රතාවය වෙනස්වේ.
F2 > Cl2 > Br2
![]() ශීඝ්රතාවය අඩු වේ
ශීඝ්රතාවය අඩු වේ
මෙහිදී I2 සමඟ ප්රතික්රියාවක් නැත.
ඉදිරියේදී ප්රශ්න ඇතුලත් වන්නේ මෙතනටයි.

